Modelo atómico de Dalton: qué es, explicación, postulados, fallos

¿Qué es el modelo atómico de Dalton?
El modelo atómico de Dalton propone que toda la materia está conformada por unidades minúsculas e indivisibles, llamadas átomos, retomando así las ideas que antiguos pensadores griegos habían formulado dos mil años atrás.
Es el primer modelo atómico surgido de una cuidadosa experimentación en el laboratorio, pues aunque la humanidad siempre ha tratado de entender qué es la materia, hasta comienzos del siglo XIX, las posibilidades de comprobar experimentalmente las teorías aún eran limitadas.
Sin embargo, aparte de ser un buen observador de la naturaleza, el maestro inglés John Dalton (1766-1844), también destacó en el campo de la instrumentación, pues creó varios aparatos de medición, que luego utilizaría en su laboratorio para el estudio de los gases.
Así, Dalton se percató de que las sustancias se combinan siguiendo ciertas reglas, y para explicarlo, postuló que toda la materia estaba compuesta de átomos, esferas diminutas, homogéneas y carentes de estructura interna. Los átomos, afirmó, forman compuestos siguiendo determinadas proporciones, y durante una reacción química, se separan y combinan nuevamente, creando nuevos compuestos.
Dalton no solo elaboró el primer modelo atómico basado en la experimentación rigurosa. También creó un sistema de nomenclatura para los elementos, los ordenó por su peso atómico, estableció la ley de las proporciones múltiples, la ley de las presiones parciales y describió la ceguera ante ciertos colores, una condición que él mismo padeció, llamada daltonismo.
Sus extensos aportes a la ciencia le valieron numerosas distinciones a lo largo de su carrera científica, pero Dalton siempre vivió de manera modesta y sencilla, dedicado a la ciencia hasta el fin de sus días.
Historia breve
Desde épocas remotas, la humanidad ha buscado una explicación acerca de la naturaleza de la materia. Los pensadores griegos del siglo V a.C, y antes que ellos, algunos filósofos hindúes, postularon que la materia estaba constituida por unidades elementales llamadas átomos. Sin embargo, carecían del apoyo experimental necesario para comprobar sus teorías.
El primer modelo atómico se atribuye a Leucipo y su discípulo Demócrito de Abdera (460 a. C. – 370 a. C.). Del primero poco se sabe, pero Demócrito fue un sabio de gran renombre, comparable a Platón y Aristóteles, aunque apenas se conservan unos pocos fragmentos de su obra.
Demócrito concibió al átomo como la partícula última que conforma la materia, indivisible e indestructible. Según sus teorías, toda la materia estaba compuesta por estas partículas, demasiado pequeñas para ser vistas. Y de acuerdo a la manera de combinarse, los átomos proporcionaban a la materia sus propiedades características.
En contraposición a esto, luego de comentar la obra de Demócrito, el afamado maestro Aristóteles determinó que la materia es continua, y que por lo tanto puede dividirse tanto como se quiera. Las ideas continuistas de Aristóteles finalmente prevalecieron hasta los comienzos del siglo XIX.
Los trabajos de Dalton
En 1793, John Dalton se interesó por la meteorología, y pasó a trabajar en el estudio de los gases atmosféricos y sus propiedades. Gracias a sus experimentos, se percató de que elementos como el oxígeno, se combinaban siempre en una proporción determinada, dada por un número entero.
En 1803, Dalton explicó que estas proporciones se deben a que la materia está compuesta por partículas básicas, llamadas átomos, tal como lo afirmara Demócrito mucho tiempo atrás. Presentó su propuesta en la obra “Nuevo sistema de filosofía química”, en la que describió los resultados de sus experimentos.
Además, en esa obra incluyó también símbolos especiales para representar los átomos individuales de cada elemento, sentando así las bases de la química moderna.
Explicación del modelo atómico de Dalton
Durante la época en que Dalton desarrolló su trabajo, otros científicos ya habían descubierto algunas de las leyes que rigen la materia y las combinaciones entre los elementos: Antoine Lavoisier estableció que, durante una reacción química, la masa no se crea o destruye, sino que se transforma.
A esta ley le siguió la ley de Proust de las proporciones definidas, estableciendo que, al combinarse dos elementos, estos lo hacen siempre en proporciones fijas.
Ahora bien, una parte de los experimentos de Dalton consistió en estudiar la absorción de los gases en el agua. Allí observó que un cierto volumen de agua solo podía absorber determinada cantidad de gas, y que esa cantidad variaba según el gas. Además, el gas se podía recuperar del agua, manteniendo intactas sus propiedades.
Había descubierto también que cuando dos elementos se pueden combinar para originar más de un compuesto, la cantidad de cada uno se mantiene fija y guardando una relación numérica sencilla, por ejemplo 1:1, 1:2; 2:3 y así. Esta es la llamada ley de las proporciones múltiples.
Para explicar estos hechos, Dalton argumentó que el gas, el agua y en general, toda la materia, se compone de piezas básicas, que, al combinarse, dan lugar a compuestos distintos. Cada elemento está constituido por unas partículas distintivas (Dalton no las llamó átomos al comienzo), pero aún en combinación, tales partículas mantienen sus cualidades inalteradas.
Postulados del modelo atómico de Dalton
El modelo atómico de Dalton se resume en las siguientes afirmaciones:
1. La materia está constituida por minúsculas partículas indivisibles llamadas átomos.
2. Cada elemento está constituido por átomos idénticos entre sí y con iguales propiedades. Los átomos de un elemento difieren de los de otros.
3. Al unirse dos o más átomos de distintos elementos, lo hacen en proporciones determinadas y sencillas, creando así los compuestos, formados por moléculas. Las moléculas de un determinado compuesto son idénticas entre sí.
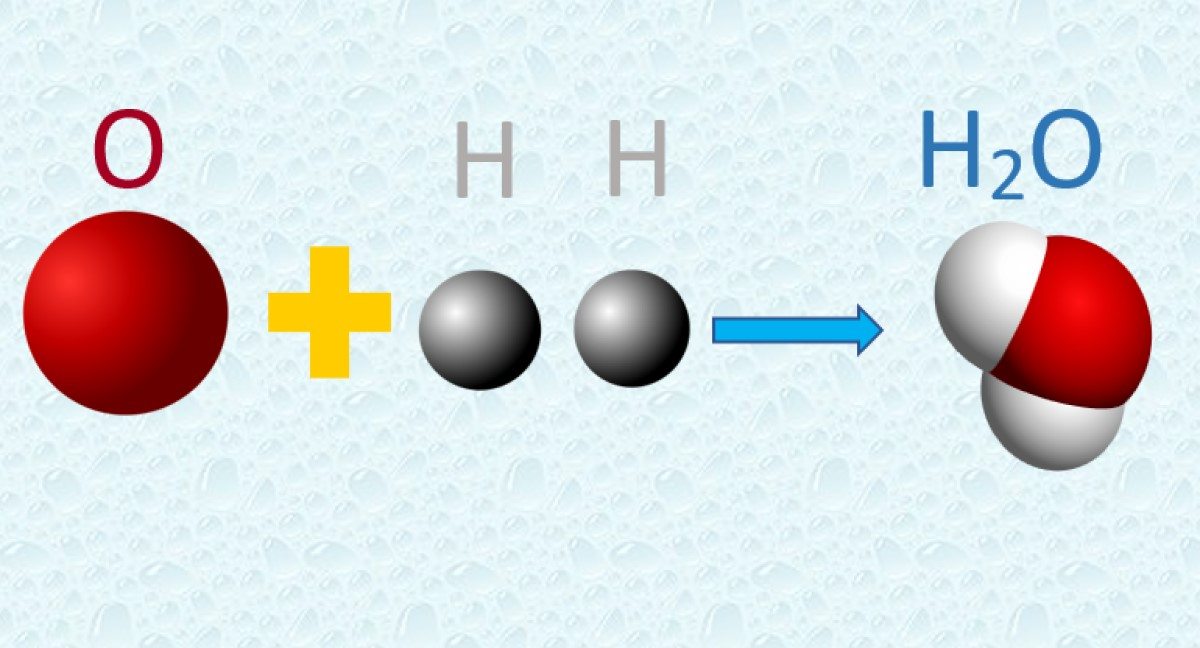
4. Durante una reacción química los átomos se intercambian, más no sufren transformación alguna, ni se crean o destruyen en el proceso.
Fallos del modelo de Dalton
La investigación científica experimentó un auge notable durante el siglo XIX, impulsada por la Revolución Industrial. Y no tardaron en ponerse de manifiesto las principales fallas del modelo atómico de Dalton:
1. El átomo no es indivisible
Este es uno de los fallos más importantes del modelo atómico de Dalton. Los experimentos realizados durante los siglos XIX y XX demostraron que el átomo se compone de multitud de partículas subatómicas.
Las primeras en conocerse fueron el electrón y el protón, y más tarde se supo de la existencia del neutrón. Después, tanto el protón como el neutrón revelaron su estructura interna.
2. Los átomos de un mismo elemento pueden no ser idénticos
Los elementos tienen isótopos que, si bien poseen las mismas propiedades químicas, difieren en el número de neutrones, por lo que su peso atómico es diferente. Por ejemplo, los isótopos del hidrógeno son el protio, el deuterio y el tritio.
3. Los átomos no son invariables
Existen sustancias radiactivas que emiten partículas y energía, transformándose en otros elementos.
4. Los átomos no siempre se combinan en proporciones enteras
Está comprobado que hay compuestos orgánicos, más complejos, que no siguen exactamente la ley de Dalton de las proporciones múltiples.
Artículos de interés
Modelo atómico de Schrödinger.
