Modelo atómico de Schrödinger: qué es, características, postulados
¿Qué es el modelo atómico de Schrödinger?
El modelo atómico de Schrödinger es una propuesta del funcionamiento y estructura del átomo desarrollado por Erwin Schrödinger en 1926. Es conocida como el modelo mecánico cuántico del átomo, y describe el comportamiento ondulatorio del electrón.
Para ello, el destacado físico austríaco se fundamentó en la hipótesis de Broglie, quien enunció que cada partícula en movimiento está asociada a una onda y puede comportarse como tal.

Schrödinger sugirió que el movimiento de los electrones en el átomo correspondía a la dualidad onda-partícula, y en consecuencia, los electrones podían movilizarse alrededor del núcleo como ondas estacionarias.
Schrödinger, quien fue galardonado con el Premio Nobel en 1933 por sus aportes a la teoría atómica, desarrolló la ecuación homónima para calcular la probabilidad de que un electrón se encuentre en una posición específica.
Características del modelo atómico de Schrödinger

-Este modelo del átomo describe el movimiento de los electrones como ondas estacionarias.
-Los electrones se mueven constantemente, es decir, no tienen una posición fija o definida dentro del átomo.
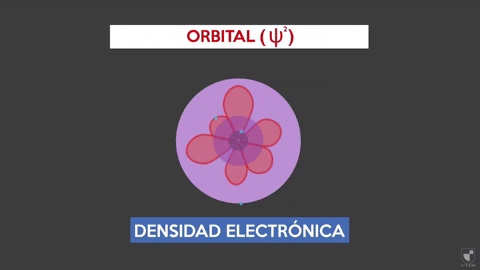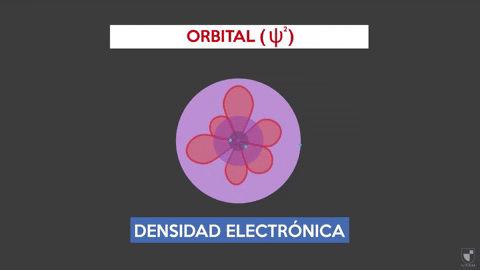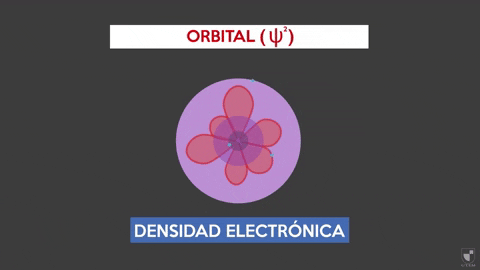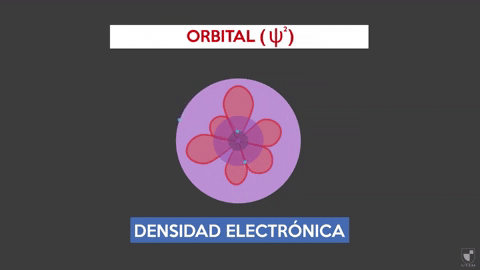
-Este modelo no predice la ubicación del electrón, ni describe la ruta que realiza dentro del átomo. Solo establece una zona de probabilidad para ubicar al electrón.
-Estas áreas de probabilidad se denominan orbitales atómicos. Los orbitales describen un movimiento de traslación alrededor del núcleo del átomo.
-Estos orbitales atómicos tienen diferentes niveles y subniveles de energía, y pueden definirse entre nubes de electrones.
-El modelo no contempla la estabilidad del núcleo, solo se remite a explicar la mecánica cuántica asociada al movimiento de los electrones dentro del átomo.
Experimento
El modelo atómico de Schrödinger se fundamenta en la hipótesis de Broglie, así como en los modelos atómicos previos de Bohr y Sommerfeld.
Broglie propuso que al igual que las ondas tienen propiedades de las partículas, las partículas tienen propiedades de las ondas, teniendo una longitud de onda asociada. Algo que generó mucha expectación en la época, siendo el propio Albert Einstein avalador de su teoría.
Sin embargo, la teoría de Broglie tenía una carencia, la cual era que no se entendía muy bien el significado de la propia idea: un electrón puede ser una onda, ¿pero de qué? Es entonces cuando aparece la figura de Schrödinger para dar respuesta.
Para ello, el físico austriaco se apoyó en el experimento de Young, y con base en sus observaciones propias, desarrolló la expresión matemática que lleva su nombre.
A continuación los cimientos científicos de este modelo atómico:
El experimento de Young: la primera demostración de la dualidad onda-partícula
La hipótesis de Broglie sobre la naturaleza ondulatoria y corpuscular de la materia puede ser demostrada mediante el Experimento de Young, también conocido como experimento de doble rendija.
El científico inglés Thomas Young sentó las bases del modelo atómico de Schrödinger cuando en 1801 realizó el experimento para comprobar la naturaleza ondulatoria de la luz.
Durante su experimentación, Young dividió la emisión de un haz de luz que atraviesa un agujero pequeño a través de una cámara de observación. Esta división se logra mediante el empleo de una tarjeta de 0,2 milímetros, ubicada paralela al haz.
El diseño del experimento estaba hecho para que el haz de luz fuese más ancho que la tarjeta, así, al colocar la tarjeta de manera horizontal, el haz se dividía en dos partes aproximadamente iguales. La salida de los haces de luz era dirigida mediante un espejo.
Ambos haces de luz impactaban sobre una pared en una habitación oscura. Allí se evidenciaba el patrón de interferencias entre ambas ondas, con lo cual quedaba demostrado que la luz podía comportarse tanto como una partícula como una onda.
Un siglo más tarde, Albert Einsten reforzó la idea mediante los principios de mecánica cuántica.
La ecuación de Schrödinger
Schrödinger desarrolló dos modelos matemáticos, diferenciando qué ocurre dependiendo si el estado cuántico cambia con el tiempo o no.
Para el análisis atómico, Schrödinger publicó a finales de 1926 la ecuación de Schrödinger independiente del tiempo, la cual se fundamenta en que las funciones de onda se comporten como ondas estacionarias.
Esto implica que la onda no se mueve, sus nodos, esto es, sus puntos de equilibrio, sirven como pivote para que el resto de la estructura se mueva alrededor de ellos, describiendo una frecuencia y amplitud determinadas.
Schrödinger definió a las ondas que describen los electrones como estados estacionarios u orbitales, y están asociados, a su vez, a distintos niveles de energía.
La ecuación de Schrödinger independiente del tiempo es la siguiente:

Donde:
E: constante de proporcionalidad.
Ψ: función de onda del sistema cuántico.
Η ̂: operador Hamiltoniano.
La ecuación de Schrödinger independiente del tiempo se emplea cuando el observable que representa la energía total del sistema, conocido como operador Hamiltoniano, no depende del tiempo. Sin embargo, la función que describe al movimiento ondulatorio total siempre dependerá del tiempo.
La ecuación de Schrödinger indica que si se tiene una función de onda Ψ, y el operador Hamiltoniano actúa sobre ella, la constante de proporcionalidad E representa la energía total del sistema cuántico en uno de sus estados estacionarios.
Aplicado al modelo atómico de Schrödinger, si el electrón se mueve en un espacio definido se tienen valores discretos de energía, y si el electrón se desplaza libremente en el espacio, se tienen intervalos continuos de energía.
Desde el punto de vista matemático, se tienen varias soluciones para la ecuación de Schrödinger, cada solución implica un valor diferente para la constante de proporcionalidad E.
Según el principio de incertidumbre de Heisenberg, no es posible estimar la posición ni la energía de un electrón. En consecuencia, los científicos reconocen que la estimación de la ubicación del electrón dentro del átomo es inexacta.
Postulados del modelo atómico de Schrödinger
Los postulados del modelo atómico de Schrödinger son los siguientes:
-Los electrones se comportan como ondas estacionarias que se distribuyen en el espacio según la función de onda Ψ.
-Los electrones se desplazan dentro del átomo describiendo orbitales. Estas son zonas en donde la probabilidad de encontrar un electrón es considerablemente más alta. La referida probabilidad es proporcional al cuadrado de la función de onda Ψ2.
La configuración electrónica del modelo atómico de Schrödinguer explica las propiedades periódicas de los átomos y los enlaces que forman.
Sin embargo, el modelo atómico de Schrödinger no contempla el spin de los electrones, y tampoco considera las variaciones del comportamiento de electrones rápidos debido a efectos relativistas.
Artículos de interés
Modelo atómico de Dirac Jordan.
Referencias
- El modelo mecánico cuántico del átomo Recuperado de: es.khanacademy.org
- La ecuación de onda de Schrödinger (s.f.). Universidad Jaime I. Castellón, España. Recuperado de: uji.es
- Modern atomic theory: models. © ABCTE. Recuperado de: abcte.org
- Schrodinger’s Atomic Model (s.f.). Recuperado de: erwinschrodingerbiography.weebly.com
- Wikipedia, La Enciclopedia Libre. Ecuación de Schrödinger. Recuperado de: es.wikipedia.org
- Wikipedia, La Enciclopedia Libre. Experimento de Young. Recuperado de: es.wikipedia.org
