Modelo atómico de Perrin: características, postulados
El modelo atómico de Perrin comparó la estructura del átomo con un sistema solar, en el cual los planetas serían las cargas negativas y el Sol sería una carga positiva concentrada en el centro del átomo. En 1895, el destacado físico francés demostró la transferencia de cargas negativas por parte de rayos catódicos hacia la superficie en la cual impactan.
Con esto se demostró la naturaleza eléctrica de los rayos catódicos y dio luces sobre la naturaleza eléctrica del átomo, entendiéndolo como la unidad más pequeña e indivisible de la materia. En 1901 Jean Baptiste Perrin sugirió que la atracción de las cargas negativas que rodean al centro (carga positiva) es contrarrestada por la fuerza de la inercia.

Este modelo fue complementado y perfeccionado posteriormente por Ernest Rutherford, quien aseveró que toda la carga positiva del átomo se ubicaba en el centro del átomo, y que los electrones orbitaban alrededor.
Sin embargo, este modelo contaba con algunas limitaciones que no pudieron ser explicadas en su momento, y el modelo fue tomado como base por el físico danés Niels Bohr para proponer su modelo en 1913.
Índice del artículo
- 1 Características del modelo atómico de Perrin
- 2 Experimento
- 3 Postulados
- 4 Limitaciones
- 5 Artículos de interés
- 6 Referencias
Las características más destacadas del modelo atómico de Perrin son las siguientes:
– El átomo está conformado por una gran partícula positiva en el centro del mismo, en la cual se concentra la mayor parte de la masa atómica.
– Alrededor de esta carga positiva concentrada orbitan varias cargas negativas que compensan la carga eléctrica total.

La propuesta de Perrin compara a la estructura atómica con un sistema solar, donde la carga positiva concentrada cumpliría la función del Sol y los electrones circundantes cumplirían el rol de los planetas.
Perrin fue pionero en sugerir la estructura discontinua del átomo en 1895. Sin embargo, nunca insistió en diseñar un experimento que ayudase a comprobar dicha concepción.
Como parte de su formación doctoral, Perrin se desempeñó como asistente de Física de la Escuela Normal Superior de París, entre 1894 y 1897.
Para entonces, Perrin desarrolló la mayor parte de su investigación en comprobar la naturaleza de los rayos catódicos; es decir, si los rayos catódicos eran partículas cargadas eléctricamente, o si tomaban la forma de las ondas.
El experimento con rayos catódicos surge al realizar investigaciones con tubos de Crookes, una estructura inventada por el químico inglés William Crookes en la década de 1870.
El tubo de Crookes está constituido por un tubo de vidrio que contiene únicamente gases en su interior. Esta configuración posee una pieza metálica en cada extremo, y cada pieza está conectada a una fuente externa de voltaje.
Cuando el tubo es energizado se ioniza el aire que se encuentra en su interior y, en consecuencia, se convierte en conductor de electricidad y cierra el circuito abierto entre los electrodos de los extremos.
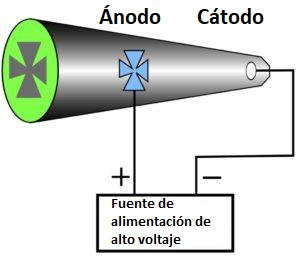
En el interior del tubo los gases adoptan un aspecto fluorescente, pero hasta finales de los años 1890 los científicos no estaban claros sobre la causa de este fenómeno.
Para entonces se desconocía si la fluorescencia se debía a la circulación de partículas elementales dentro del tubo, o si los rayos adoptaban la forma de las ondas que los transportaban.
En 1895 Perrin replicó los experimentos de rayos catódicos conectando un tubo de descarga a un recipiente vacío de mayor tamaño.
En complemento, Perrin colocó una pared impermeable para moléculas ordinarias y replicó la configuración de Crookes colocando una Jaula de Faraday, contenida dentro de una cámara protectora.
Si los rayos atravesaban la pared impermeable para moléculas ordinarias dentro de la jaula de Faraday, quedaría automáticamente demostrado que los rayos catódicos estaban compuestos por partículas fundamentales cargadas eléctricamente.
Para corroborar esto, Perrin conectó un electrómetro cerca de la pared impermeable para medir las cargas eléctricas que se producirían cuando los rayos catódicos impactasen allí.
Al realizar el experimento, se evidenció que el choque de los rayos catódicos contra la pared impermeable indujo una medición pequeña de carga negativa en el electrómetro.
Posteriormente, Perrin desvió el flujo de rayos catódicos forzando el sistema mediante la inducción de un campo eléctrico, y forzó a que los rayos catódicos impactaran en contra del electrómetro. Cuando eso ocurrió, el medidor registró una carga eléctrica considerablemente superior en comparación con el registro anterior.
Gracias a las experimentaciones de Perrin, se demostró que los rayos catódicos estaban constituidos por partículas con cargas negativas.
Posteriormente, a principios del siglo XX, J. J. Thomson descubrió formalmente la existencia de los electrones y su relación carga-masa, con base en las investigaciones de Perrin.
En 1904 el científico británico J.J. Thomson enunció su propuesta de modelo atómico, también conocido como modelo del budín de ciruela.
En dicho modelo, la carga positiva se entendía como una masa homogénea y las cargas negativas estarían dispersas de forma aleatoria sobre dicha masa positiva.
En la analogía, la carga positiva sería la masa del budín, y las cargas negativas estarían representadas por las ciruelas. Este modelo fue refutado por Perrin en 1907. En su propuesta, Perrin indica lo siguiente:
- La carga positiva no está expandida a lo largo y ancho de toda la estructura atómica. Por el contrario, está concentrada en el centro del átomo.
- Las cargas negativas no están dispersas a través del átomo. En cambio, estas se ubican de manera ordenada alrededor de la carga positiva, hacia el borde exterior del átomo.
El modelo atómico de Perrin cuenta con dos grandes restricciones, que a posteriori fueron superadas gracias a los aportes de Bohr (1913) y de la física cuántica.
Las limitaciones más significativas de esta propuesta son:
- No se cuenta con una explicación acerca de por qué la carga positiva se mantiene concentrada en el centro del átomo.
- No se entiende la estabilidad de las órbitas de las cargas negativas en torno al centro del átomo.
- De acuerdo con las leyes electromagnéticas de Maxwell, las cargas negativas describirían órbitas espirales alrededor de las cargas positivas, hasta colisionar con estas.
Modelo atómico de Schrödinger.
Modelo atómico de Dirac Jordan.
- Jean Perrin (1998). Encyclopædia Britannica, Inc. Recuperado de: britannica.com
- Jean Baptiste Perrin (20014). Encyclopedia of World Biography. Recuperado de: encyclopedia.com
- Kubbinga, H. (2013). A tribute to Jean Perrin. © European Physical Society. Recuperado de: europhysicsnews.org
- Modelo atómico (s.f.). La Habana, Cuba. Recuperado de: ecured.cu
- Perrin, J (1926). Discontinuous Structure of Matter. Nobel Media AB. Recuperado de: nobelprize.org
- Solbes, J., Silvestre, V. y Furió, C. (2010). El desarrollo histórico de los modelos de átomo y enlace químico y sus implicaciones didácticas. Universitat de València. Valencia, España. Recuperado de: ojs.uv.es
