Modelo atómico actual: características, postulados y científicos influyentes
¿Qué es el modelo atómico actual?
El modelo atómico actual es el que está basado en la mecánica cuántica, particularmente en la ecuación de Schrödinger, en el principio de exclusión de Pauli y una propiedad del electrón denominada spin o espin.
Es el modelo de mayor aceptación y uso en el estudio de la estructura de átomos, moléculas y en la reactividad química de los elementos, debido a la precisión de sus predicciones y su relativa sencillez.

Este modelo es la evolución de varios modelos atómicos anteriores, como el modelo de Rutherford y el de Bohr – Sommerfeld, considerados modelos clásicos o semi-clásicos.
En la actualidad hay modelos teóricamente más completos que el modelo mecanocuántico de Schrödinger, como el modelo de Dirac-Jordan, que incorpora la relatividad especial y se basa en la ecuación de onda de Dirac. En esta ecuación el spin, la propiedad de los electrones mencionada al principio, aparece de forma natural.
También están los modelos basados en la teoría cuántica de campos, aplicados en física de altas energías. Estos modelos son excelentes en la predicción de la creación y aniquilación de partículas fundamentales, el objetivo de este campo de la física.
Cabe mencionar que las teorías más sofisticadas convergen al los mismos resultados que los de la ecuación de Schrödinger, sobre todo para los átomos ligeros.
Características del modelo atómico actual
En la visión del átomo actual, basado en la mecánica cuántica no-relativista, no cabe el concepto de órbitas electrónicas al estilo de sistemas planetarios.
Sin embargo, la imagen más difundida del átomo sigue siendo la de un núcleo central positivo y unos puntitos de carga eléctrica negativa (los electrones), girando en órbitas perfectamente definidas en torno al núcleo central. Pero a pesar de su arraigo, ya no se corresponde con el modelo atómico actual.
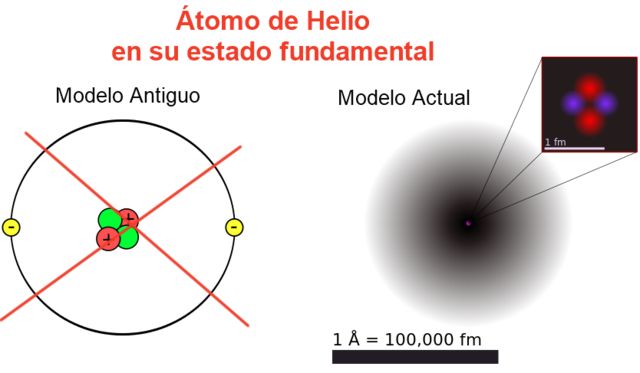
En la figura 2 se muestra la imagen antigua y la imagen actual de un átomo de helio en su estado de menor energía (nivel n = 1 y l = 0).
La imagen clásica es útil para ver que el núcleo contiene dos protones y dos neutrones. Garantizando la neutralidad del átomo hay dos electrones ocupando el mismo nivel de energía.
Del resto es una imagen alejada de la realidad, puesto que la escala del núcleo ni siquiera corresponde con la del átomo: el núcleo es 1/100000 veces el tamaño del átomo, pero es allí donde se concentra la masa atómica.
Dualidad onda – partícula
La mecánica clásica establece que toda partícula material tiene una onda asociada, denominada función de onda. Esta es la famosa dualidad onda-partícula de Louis De Broglie.
En el modelo atómico actual, el comportamiento del electrón a la escala de los átomos es prominentemente ondulatorio, mientras que a nivel macroscópico, como los electrones que se mueven en los tubos de rayos catódicos de los antiguos televisores, predomina el comportamiento corpuscular.
En cambio con los fotones, sucede al contrario, en la mayoría de los fenómenos ópticos (a nivel macroscópico) tienen un comportamiento fundamentalmente ondulatorio. Y cuando interactúan con los átomos de materia, tienen un comportamiento de partícula.
Debido a esto, los electrones alrededor del núcleo están esparcidos en zonas denominadas orbitales atómicos, cuya forma y extensión dependerá del nivel de energía de los electrones y del momentum angular.
Tanto la energía como el momentum angular del electrón en torno al núcleo tienen ciertos valores permitidos, por lo tanto se dice que están cuantizados.
La ecuación de onda de Schrödinger predice cuáles valores de energía y momentum angular son permitidos, así como la función de onda asociada a cada nivel de energía y momentum.
El cuadrado matemático de la función de onda determina los orbitales, es decir las zonas en torno al núcleo donde los electrones podrán encontrarse con mayor probabilidad.
El tamaño del átomo
Para tener una imagen a escala del modelo atómico actual, imaginemos que un átomo tiene un diámetro como el de una cancha de fútbol. El núcleo sería como una hormiga en el centro del campo, pero asombrosamente con el 99,9% de la masa atómica.
Por otra parte, los electrones serían como jugadores fantasmales difusos por todo el campo, con mayor probabilidad de ser encontrados en el medio campo.
Hay unas cuantas alineaciones o formas permitidas de ocupar el campo, las cuales dependen de la energía de los jugadores (los electrones) y la cantidad de “giro” o spin en torno al centro.
Postulados del modelo atómico actual
1.- El electrón se caracteriza por su masa m, por su espín s y por ser la partícula portadora de carga negativa elemental (-e).
2.- Los electrones tienen comportamiento dual, de onda-partícula simultáneo, pero dependiendo de su energía y de la escala del fenómeno puede ser más preponderante uno que el otro.
3.- Los electrones rodean al núcleo atómico positivo, de forma tal que garantizan la neutralidad eléctrica del átomo. Por lo tanto, la cantidad de electrones es igual a la de protones; este es el número atómico, que le confiere las características químicas y físicas de cada elemento.
4.- La interacción entre electrones y núcleo se modela mediante el potencial V(r) electrostático de Coulomb, al cual se le incorpora el término de la energía potencial en el operador hamiltoniano.
5.- El término de energía cinética en el operador hamiltoniano es un operador que se construye a partir del operador del momentum lineal, siendo el mismo:
p = – i ħ ∂ /∂r
Donde ħ es la constante de Planck dividida entre 2π.
6.- El operador hamiltoniano H = (p⋅p)/2m – e V(r) actúa sobre la función de onda del electrón Ψ(r).
7.- Como se buscan las soluciones estacionarias de la función de onda electrónica se usa la ecuación de Schrödinger independiente del tiempo:
H Ψ(r) = E Ψ(r)
Donde E representa la energía total del electrón.
8.- En los átomos con varios electrones no se toma en cuenta la interacción entre ellos.
9.- Cuando se trata de átomos de muchos electrones los orbitales de los electrones más externos se modelan por el potencial del núcleo apantallado por los electrones más internos, el cual se conoce como potencial de Debye.
10.- La ecuación (7) tiene solución para algunos valores discretos de energía, de modo que los famosos cuantos de Planck, aparecen naturalmente de las soluciones de la ecuación de Schrödinger.
11.- Para cada valor discreto de E hay una función de onda. Pero algunas soluciones son degeneradas, dependiendo del valor del momentum angular L.
12.- La función de onda es el producto de una función radial, la función azimutal y la función polar.
13.- Dicha función de onda determina las regiones permitidas para el electrón. El cuadrado de la función de onda es la densidad de probabilidad de encontrar el electrón en determinada posición, vista desde el centro del núcleo atómico.
14.- El spin no aparece en la ecuación de Schrödinger, pero se incorpora en el modelo atómico mediante el principio de Pauli:
El electrón es un fermión con dos estados posibles de espín +½ y -½.
Así que un mismo estado caracterizado por los números cuánticos n, l, m de la ecuación de Schrödinger, puede estar ocupado a lo sumo por 2 electrones con espines contrarios. De esta forma el espin pasa a ser el cuarto número cuántico.
Científicos influyentes en el modelo atómico actual
Parece increíble, pero la mayor parte de los físicos que contribuyeron al modelo atómico actual aparecen en una misma foto. Se reunieron en las famosas conferencias patrocinadas por Ernest Solvay, un químico e industrial de origen belga, que llegaron a ser famosas en el mundo de la ciencia.
Comenzaron a celebrarse desde 1911 y reunían a los más grandes científicos del momento, entre ellos estuvieron prácticamente todos los que dieron su aporte al modelo atómico actual.
La más famosa de estas conferencias se celebró en Bruselas en 1927 y allí se tomó esta fotografía histórica:


- Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Théophile de Donder
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Émile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max Born
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Brillouin
- Niels Bohr
- Owen Williams Richardson
Artículos de interés
Modelo atómico de Schrödinger.
Modelo atómico de Dirac Jordan.
Referencias
- Alonso – Finn. Fundamentos cuánticos y estadísticos. Addison Wesley.
- Bauer, W. 2011. Física para Ingeniería y Ciencias. Volumen 1. Mc Graw Hill.
- Eisberg y Resnick. Física Cuántica. Limusa – Wiley.
- Wikipedia. Teoría atómica. Recuperado de: es.wikipedia.com
- Zapata F. Modelo mecanocuántico del átomo. Recuperado de: lifeder.com
