Modelo atómico de Thomson: características, postulados, partículas subatómicas
El modelo atómico de Thomson fue creado por el celebrado físico inglés J. J. Thomson, quien descubrió el electrón. Por este descubrimiento y sus trabajos acerca de la conducción eléctrica en los gases, fue galardonado en 1906 con el Premio Nobel de Física.
A partir de sus trabajos con los rayos catódicos, se puso de manifiesto que el átomo no era una entidad indivisible, como había postulado Dalton en el modelo precedente, sino que contenía una estructura interna bien definida.

Thomson elaboró un modelo del átomo partiendo de los resultados de sus experimentos con rayos catódicos. En él afirmó que el átomo, eléctricamente neutro, estaba formado de cargas positivas y negativas de igual magnitud.
Índice del artículo
- 1 ¿Cómo se llamó el modelo atómico de Thomson y porqué?
- 2 Características y postulados del modelo de Thomson
- 3 Partículas subatómicas del modelo atómico de Thomson
- 4 El experimento de Thomson
- 5 Diferencias de modelos de Thomson y Dalton
- 6 Fallos y limitaciones del modelo
- 7 Artículos de interés
- 8 Referencias
Según Thomson, la carga positiva estaba distribuida por todo el átomo y las cargas negativas estaban incrustadas en él como si fueran las pasas de un pudín. De esta comparación surgió el término “pudín de pasas”, como se conoció informalmente al modelo.
Si bien en la actualidad la idea de Thomson luce bastante primitiva, para su momento representó un aporte novedoso. Durante la breve vigencia del modelo (desde 1904 hasta 1910), contó con el apoyo de muchos científicos, aunque otros tantos lo consideraron herejía.
Finalmente en 1910 surgió nueva evidencia acerca de la estructura atómica y el modelo de Thomson rápidamente quedó a un lado. Esto ocurrió tan pronto como Rutherford publicó los resultados de sus experimentos de dispersión, que pusieron de manifiesto la existencia del núcleo atómico.
Sin embargo, el modelo de Thomson fue el primero en postular la existencia de partículas subatómicas y sus resultados fueron el fruto de una fina y rigurosa experimentación. De esta manera estableció el precedente para todos los descubrimientos que siguieron.
Thomson llegó a su modelo atómico partiendo de varias observaciones. La primera fue que los rayos X recién descubiertos por Roentgen eran capaces de ionizar las moléculas de aire. Hasta entonces, la única forma de ionizar era separando químicamente iones en una solución.
Pero el físico inglés logró ionizar con éxito incluso gases monoatómicos como el helio, mediante los rayos X. Esto lo condujo a creer que la carga dentro del átomo podía ser separada, y que por lo tanto no era indivisible.También observó que los rayos catódicos podían ser desviados por los campos eléctricos y magnéticos.

Entonces Thomson ideó un modelo que explicaba correctamente el hecho de que el átomo es eléctricamente neutro y que los rayos catódicos están compuestos de partículas con carga negativa.
Sirviéndose de la evidencia experimental, Thomson caracterizó al átomo de la siguiente forma:
-El átomo es una esfera maciza eléctricamente neutra, con un radio aproximado de 10-10 m.
-La carga positiva está repartida de manera más o menos uniforme por la esfera.
-El átomo contiene “corpúsculos” cargados negativamente, que aseguran su neutralidad.
-Dichos corpúsculos son los mismos para toda la materia.
-Cuando el átomo está en equilibrio, hay n corpúsculos dispuestos regularmente en anillos dentro de la esfera de carga positiva.
-La masa del átomo está repartida uniformemente.
Thomson llevó a cabo sus experimentos utilizando los rayos catódicos, descubiertos en 1859. Los rayos catódicos son haces de partículas cargadas negativamente. Para producirlos se emplean tubos de cristal al vacío, en los cuales se colocan dos electrodos, denominados cátodo y ánodo.
Seguidamente se hace pasar una corriente eléctrica que calienta al cátodo, que de esta forma emite una radiación invisible que se dirige directamente al electrodo opuesto.
Para detectar la radiación, que no es otra cosa que los rayos catódicos, se cubre la pared del tubo detrás del ánodo con un material fluorescente. Cuando la radiación llega hasta allí, la pared del tubo desprende una intensa luminosidad.
Si se interpone un objeto sólido en el camino de los rayos catódicos, este arroja una sombra sobre la pared del tubo. Esto indica que los rayos viajan en línea recta, y también que se los puede bloquear fácilmente.
La naturaleza de los rayos catódicos fue ampliamente discutida, pues su naturaleza era una incógnita. Algunos pensaban que eran ondas de tipo electromagnético, mientras que otros sostenían que eran partículas.
El modelo atómico de Thomson es, como dijimos, el primero en postular la existencia de partículas subatómicas. Los corpúsculos de Thomson no son otra cosa que los electrones, las partículas fundamentales del átomo cargadas negativamente.
Actualmente sabemos que las otras dos partículas fundamentales son el protón, cargado positivamente, y el neutrón sin carga.
Pero estas no fueron descubiertas en el momento en que Thomson elaboró su modelo. La carga positiva en el átomo estaba distribuida en él, no consideraba ninguna partícula portadora de dicha carga y por el momento no había evidencia alguna de su existencia.
Por este motivo su modelo tuvo una existencia fugaz, ya que en el transcurso de pocos años, los experimentos de dispersión de Rutherford abrieron el camino para el descubrimiento del protón. Y en cuanto al neutrón, el mismo Rutherford propuso su existencia algunos años antes de que finalmente fuera descubierto.
Sir William Crookes (1832-1919) diseñó el tubo que lleva su nombre hacia 1870, con la intención de estudiar cuidadosamente la naturaleza de los rayos catódicos. Agregó campos eléctricos y campos magnéticos, y observó que los rayos eran desviados por estos.

De esta forma, Crookes y otros investigadores, incluyendo a Thomson, encontraron que:
- Se generaba una corriente eléctrica en el interior del tubo de rayos catódicos
- Los rayos eran desviados por la presencia de campos magnéticos, de la misma forma en que lo eran las partículas cargadas negativamente.
- Cualquier metal empleado para fabricar el cátodo servía igualmente bien para producir rayos catódicos, y el comportamiento de estos era independiente del material.
Estas observaciones avivaron la discusión en torno al origen de los rayos catódicos. Quienes sostenían que eran ondas, se basaban en que los rayos catódicos podían viajar en línea recta. Además, esta hipótesis explicaba muy bien la sombra que un objeto sólido interpuesto arrojaba en la pared del tubo y bajo ciertas circunstancias, se sabía que las ondas podían causar fluorescencia.
Pero en cambio no se entendía cómo era posible que los campos magnéticos desviaran los rayos catódicos. Esto solamente tenía explicación si se consideraba a dichos rayos como partículas, una hipótesis que Thomson compartía.
Una partícula cargada con carga q, experimenta una fuerza Fe en medio de un campo eléctrico uniforme E, de magnitud:
Fe = qE
Cuando una partícula cargada atraviesa perpendicularmente un campo eléctrico uniforme, como el que se produce entre dos placas con cargas opuestas, experimenta una desviación, y por consiguiente una aceleración:
qE = ma
a = qE/m
Por otra parte, si la partícula cargada se mueve con velocidad de magnitud v, en medio de un campo magnético uniforme de magnitud B, la fuerza magnética Fm que experimenta tiene la siguiente intensidad:
Fm =qvB
Siempre y cuando los vectores velocidad y campo magnético sean perpendiculares. Cuando una partícula cargada incide perpendicularmente en un campo magnético homogéneo, también experimenta una desviación y su movimiento es circular uniforme.
La aceleración centrípeta ac en este caso es:
qvB = mac
A su vez la aceleración centrípeta está relacionada con la rapidez de la partícula v y el radio R de la trayectoria circular:
ac = v2/R
Por lo tanto:
qvB = mv2/R
El radio de la trayectoria circular podría calcularse de la siguiente manera:
R = mv/qB
Más adelante se utilizarán estas ecuaciones para recrear la forma en que Thomson dedujo la relación carga-masa del electrón.
Thomson hizo pasar un haz de rayos catódicos, un haz de electrones, aunque él aún no lo sabía, a través de campos eléctricos uniformes. Estos campos se crean entre dos placas conductoras cargadas y separadas a una pequeña distancia.
También hizo pasar los rayos catódicos por un campo magnético uniforme, observando el efecto que esto tenía en el haz. Tanto en un campo como el otro, se producía una deflexión en los rayos, lo cual llevó a Thomson a pensar, acertadamente, que el haz estaba compuesto de partículas cargadas.
Para comprobarlo, Thomson llevó a cabo varias estrategias con los rayos catódicos:
- Hizo variar los campos eléctricos y magnéticos hasta lograr que las fuerzas se cancelaran. De esta manera los rayos catódicos pasaban a través sin experimentar deflexión. Igualando las fuerzas eléctrica y magnética, Thomson logró determinar la velocidad de las partículas del haz.
- Anuló la intensidad del campo eléctrico, de esta manera las partículas siguieron una trayectoria circular en medio del campo magnético.
- Combinó los resultados de los pasos 1 y 2 para determinar la relación carga-masa de los “corpúsculos”.
Thomson determinó que la relación carga-masa de las partículas que constituían el haz de rayos catódicos tiene el siguiente valor :
q/m = 1.758820 x 10 11 C.kg-1.
Donde q representa la carga del “corpúsculo”, que es en realidad el electrón y m es la masa del mismo. Thomson siguió el procedimiento descrito en la sección anterior, el cual recreamos aquí paso a paso, con las ecuaciones que él utilizó.
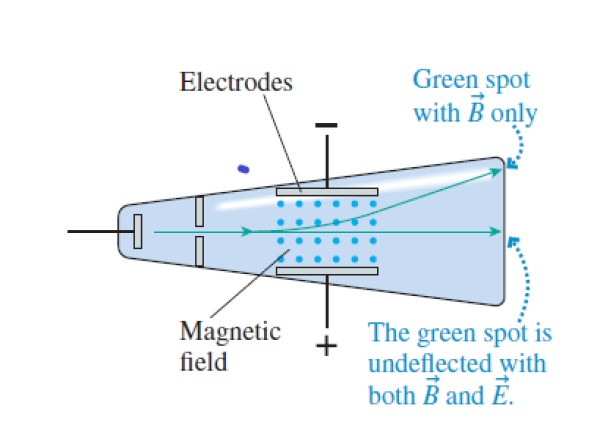
Paso 1
Igualar la fuerza eléctrica y la fuerza magnética, haciendo pasar el haz por los campos eléctrico y magnético perpendiculares:
qvB = qE
Paso 2
Determinar la velocidad adquirida por las partículas del haz cuando pasan directamente sin deflexión:
v = E/B
Paso 3
Anular el campo eléctrico, dejando solamente el campo magnético (ahora sí hay deflexión):
R = mv/qB
Con v = E/B resulta:
R = mE/qB2
El radio de la órbita puede medirse, por lo tanto:
q/m = v/RB
O bien:
q/m = E/RB2
Siguientes pasos
Lo siguiente que hizo Thomson fue medir el cociente q/m utilizando cátodos hechos de distintos materiales. Tal como se dijo anteriormente, todos los metales emitían rayos catódicos con idénticas características.
Después Thomson comparó sus valores con los del cociente q/m del ión hidrógeno, obtenido por electrólisis y cuyo valor es aproximadamente de 1 x 108 C/kg. El cociente carga-masa del electrón es aproximadamente 1750 veces mayor que el de ión de hidrógeno.
Por lo tanto los rayos catódicos tenían mucha mayor carga, o tal vez una masa muchísimo menor que la del ión hidrógeno. El ión hidrógeno es simplemente un protón, cuya existencia se conoció tiempo después de los experimentos de dispersión de Rutherford.
Hoy día se sabe que el protón es casi 1800 veces más masivo que el electrón y con carga de igual magnitud y signo contrario a la del electrón.
Otro detalle importante es que con los experimentos de Thomson no se determinó directamente la carga eléctrica del electrón, ni tampoco el valor de su masa por separado. Estos valores se determinaron mediante los experimentos de Millikan, que comenzaron en 1906.
La diferencia fundamental de estos dos modelos, es que Dalton pensaba que el átomo es una esfera. Al contrario de Thomson, no propuso la existencia de cargas positivas o negativas. Para Dalton un átomo era así:

Como hemos visto anteriormente, Thomson pensaba que el átomo sí era divisible, y cuya estructura está formada por una esfera positiva y electrones alrededor.
En su momento, el modelo atómico de Thomson consiguió explicar muy bien el comportamiento químico de las sustancias. También explicó acertadamente los fenómenos que ocurrían en el tubo de rayos catódicos.
Pero de hecho Thomson ni siquiera llamó a sus partículas “electrones”, aunque el término ya había sido acuñado previamente por George Johnstone Stoney. Thomson simplemente les denominaba “corpúsculos”.
Aunque Thomson hizo uso de todo el conocimiento del que disponía para el momento, hay varias limitaciones importantes en su modelo, que fueron evidentes muy pronto:
–La carga positiva no está repartida por todo el átomo. Los experimentos de la dispersión de Rutherford mostraron que la carga positiva del átomo necesariamente está confinada a una pequeña región del mismo, que luego pasó a ser conocida como el núcleo atómico.
–Los electrones poseen una distribución específica dentro de cada átomo. Los electrones no están repartidos de manera uniforme, como las pasas del famoso budín, sino que tienen una disposición en orbitales que los modelos posteriores pusieron de manifiesto.
Es justamente la disposición de los electrones dentro del átomo la que permite organizar los elementos por sus características y propiedades en la tabla periódica. Esta era una limitación importante del modelo Thomson, que no podía explicar cómo era posible ordenar a los elementos de esta manera.
–El núcleo atómico es el que contiene la mayor parte de la masa. El modelo de Thomson postuló que la masa del átomo estaba repartida uniformemente en su interior. Pero hoy en día sabemos que la masa del átomo está prácticamente concentrada en los protones y neutrones del núcleo.
Es importante destacar también que este modelo del átomo no permitía inferir el tipo de movimiento que tenían los electrones dentro del átomo.
Modelo atómico de Schrödinger.
Modelo atómico de Dirac Jordan.
- Andriessen, M. 2001. HSC Course. Physics 2. Jacaranda HSC Science.
- Arfken, G. 1984. University Physics. Academic Press.
- Knight, R. 2017. Physics for Scientists and Engineering: a Strategy Approach. Pearson.
- Rex, A. 2011. Fundamentos de Física. Pearson.
- Wikipedia. Modelo atómico de Thomson. Recobrado de: es.wikipedia.org.
