Modelo atómico de Rutherford: historia, experimentos, postulados
El modelo atómico de Rutherford es la descripción del átomo creada por el físico británico Ernest Rutherford (1871-1937) cuando en 1911 descubrió el núcleo atómico, gracias a los famosos experimentos de dispersión que llevan su nombre.
La idea del átomo (“indivisible” en griego) como el componente más pequeño de la materia, fue una creación intelectual nacida en la Antigua Grecia, alrededor del año 300 a.C. Como tantos otros conceptos griegos, el concepto del átomo es desarrollado en base a la lógica y la argumentación, más no a la experimentación.

Los filósofos atomistas más notables fueron Demócrito de Abdera (460 – 360 AC), Epicuro de Samos (341 – 270 AC) y Tito Lucrecio (98 – 54 AC). Los griegos concibieron cuatro tipos diferentes de átomos que se correspondían con los cuatro elementos que según ellos conformaban la materia: aire, agua, tierra y fuego.
Posteriormente Aristóteles añadiría un quinto elemento: el éter que formaba a las estrellas, ya que los otro cuatro elementos eran puramente terrestres.
Las conquistas de Alejandro Magno, de quien Aristóteles fue maestro, expandieron las creencias de éste por el mundo antiguo, desde España hasta la India y así, durante siglos, la idea del átomo fue creando un lugar propio en el mundo de la ciencia.
Índice del artículo
- 1 El átomo deja de ser indivisible
- 2 El descubrimiento del electrón
- 3 Experimentos de dispersión de Rutherford: el núcleo atómico y el protón
- 4 Postulados del modelo atómico de Rutherford
- 5 Limitaciones
- 6 Artículos de interés
- 7 Referencias
Las ideas de los filósofos griegos acerca de la estructura de la materia se mantuvieron como ciertas durante cientos de años, hasta que un químico y maestro de escuela inglés llamado John Dalton (1776-1844) publicó los resultados de sus experimentos en 1808.
Dalton concordaba en que los elementos están formados por partículas extremadamente pequeñas, llamadas átomos. Pero fue más lejos al afirmar que todos los átomos de un mismo elemento son iguales, tienen el mismo tamaño, la misma masa y las mismas propiedades químicas, que los hace permanecer inalterables durante una reacción química.
Este es el primer modelo atómico con fundamento científico. Al igual que los griegos, Dalton seguía considerando al átomo como indivisible, por lo tanto, carente de estructura. Sin embargo, la genialidad de Dalton lo llevó a observar uno de los grandes principios de conservación de la Física:
- En las reacciones químicas, los átomos ni se crean ni se destruyen, solo cambian su distribución.
Y estableció la forma en que los compuestos químicos se formaban mediante los “átomos de compuesto” (moléculas):
- Cuando dos o más átomos de diferentes elementos se combinan para formar un mismo compuesto, lo hacen siempre en proporciones de masa definidas y constantes.
El siglo XIX fue el gran siglo de la electricidad y el magnetismo. Unos pocos años después de las publicaciones de Dalton, los resultados de algunos experimentos sembraron dudas entre los científicos acerca de la indivisibilidad del átomo.
El tubo de Crookes fue un dispositivo diseñado por el químico y meteorólogo británico William Crookes (1832-1919). El experimento que Crookes llevó a cabo en 1875, consistía en colocar, dentro de un tubo lleno de gas a baja presión, dos electrodos, uno denominado cátodo y otro denominado ánodo.
Al establecer una diferencia de potencial entre ambos electrodos, el gas resplandecía con un color que era característico del gas utilizado. Este hecho hacía pensar que existía una cierta organización particular dentro del átomo y que por lo tanto, éste no era indivisible.
Además esta radiación producía una débil fluorescencia en la pared del tubo de vidrio enfrente del cátodo, recortando la sombra de una marca en forma de cruz ubicada en el interior del tubo.
Se trataba de una misteriosa radiación conocida como “rayos catódicos”, que viajaba en línea recta hasta el ánodo y que era altamente energética, capaz de producir efectos mecánicos, y que se desviaba hacia una placa cargada positivamente o también mediante imanes.
La radiación en el interior del tubo de Crookes no podía tratarse de ondas, pues llevaba carga negativa. Joseph John Thomson (1856 – 1940) dio con la respuesta en 1887 cuando encontró la relación entre la carga y la masa de esta radiación, y halló que siempre era la misma: 1,76 x 1011 C/Kg., independientemente del gas encerrado en el tubo o del material empleado en fabricar el cátodo.
Thomson llamó a estas partículas corpúsculos. Al medir su masa en relación con su carga eléctrica concluyó que cada corpúsculo era muchísimo más pequeño que un átomo. Por lo tanto, sugirió que debían formar parte de estos, descubriendo así al electrón.
El científico británico fue el primero en esbozar un modelo gráfico del átomo, mediante el dibujo de una esfera con unos puntos insertados, al que por su forma se le dio el apelativo de “budín de ciruela”. Pero este descubrimiento trajo otras interrogantes:
- Si la materia es neutra, y el electrón tiene carga negativa: ¿en que parte del átomo se encuentra la carga positiva que neutraliza a los electrones?
- Si la masa del electrón es inferior a la del átomo, entonces ¿en qué consiste el resto del átomo?
- ¿Por qué las partículas así obtenidas siempre eran electrones y nunca de otro tipo?
Hacia 1898 Rutherford había identificado dos tipos de radiación provenientes del uranio, a las cuales denominó alfa y beta.
La radiactividad natural ya había sido descubierta por Marie Curie en 1896. Las partículas alfa tienen carga positiva y son simplemente núcleos de helio, pero en ese entonces el concepto de núcleo no se conocía aún. Rutherford estaba por descubrirlo.
Uno de los experimentos que Rutherford realizó en 1911 en la Universidad de Manchester, con la asistencia de Hans Geiger, consistía en bombardear una fina lámina de oro con partículas alfa, cuya carga es positiva. Alrededor de la lámina de oro colocó una pantalla fluorescente que les permitía visualizar los efectos del bombardeo.
Estudiando los impactos sobre la pantalla fluorescente, Rutherford y sus asistentes observaron que:
- Un elevadísimo porcentaje de las partículas alfa atravesaban la lámina sin desviación perceptible.
- Algunas se desviaban en ángulos bastante pronunciados
- Y poquísimas rebotaban completamente hacia atrás
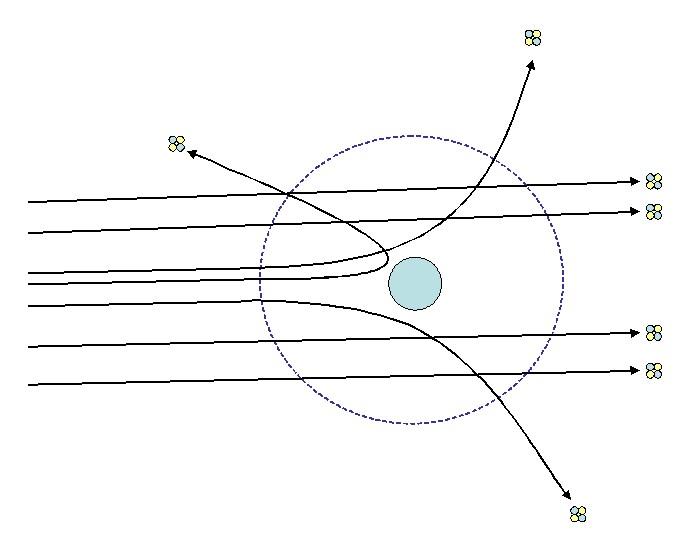
Las observaciones 2 y 3 sorprendieron a los investigadores y los condujo a suponer que el responsable de que los rayos se dispersaran debía tener carga positiva y que en virtud de la observación número 1, ese responsable tenía un tamaño muchísimo menor que el de las partículas alfa.
El mismo Rutherford dijo al respecto que era “…como si dispararas un proyectil naval de 15 pulgadas contra una hoja de papel y el proyectil rebotara hacia atrás y te golpeara a ti”. Esto definitivamente no podía ser explicado por el modelo de Thompson.
Analizando sus resultados desde el punto de vista clásico, Rutherford había descubierto la existencia del núcleo atómico, donde se concentraba la carga positiva del átomo que le brindaba a este su neutralidad.
Rutherford prosiguió con sus experimentos de dispersión. Hacia 1918 la nueva diana de las partículas alfa fueron los átomos de nitrógeno gaseoso.
De esta manera detectó núcleos de hidrógeno y supo de inmediato que el único sitio del cual podían provenir estos núcleos era del nitrógeno mismo. ¿Cómo era posible que los núcleos de hidrógeno formaran parte del nitrógeno?
Rutherford sugirió entonces que el núcleo de hidrógeno, elemento al que ya se le había asignado el número atómico 1, debía ser una partícula fundamental. La llamó protón, vocablo griego para designar primero. Así, los descubrimientos del núcleo atómico y del protón son debidos a este brillante neozelandés.
El nuevo modelo era muy diferente al de Thompson. Estos fueron sus postulados:
- El átomo contiene un núcleo cargado positivamente, que pese a ser muy pequeño, contiene casi toda la masa del átomo.
- Los electrones orbitan el núcleo atómico a gran distancia y en órbitas circulares o elípticas.
- La carga neta del átomo es nula, ya que las cargas de los electrones compensa la carga positiva presente en el núcleo.
Los cálculos de Rutherford apuntaron a un núcleo de forma esférica y un radio tan pequeño como 10-15 m, siendo el valor del radio atómico unas 100.000 veces mayor, ya que los núcleos están comparativamente muy distanciados entre sí: del orden de 10-10 m.

Ello explica por qué la mayoría de las partículas alfa atravesaban la lámina sin inconveniente o apenas experimentaban una deflexión muy pequeña.
Visto a escala de objetos cotidianos, el átomo de Rutherford estaría compuesto de un núcleo del tamaño de una pelota de béisbol, mientras que el radio atómico sería de unos 8 Km. Por lo tanto el átomo puede considerarse casi todo como espacio vacío.
Gracias a su semejanza con un sistema solar en miniatura, se le conoció como “modelo planetario del átomo”. La fuerza de atracción electrostática entre núcleo y electrones, sería análoga a la atracción gravitatoria entre el sol y los planetas.
Sin embargo había ciertas discordancias respecto a algunos hechos observados:
- Si se acepta la idea de que el electrón orbita alrededor del núcleo, ocurre que el electrón debería emitir continuamente radiación hasta chocar con el núcleo, con la consiguiente destrucción del átomo en bastante menos de un segundo. Esto, afortunadamente no es lo que sucede en realidad.
- Además, en ciertas ocasiones el átomo emite determinadas frecuencias de radiación electromagnética cuando hay transiciones entre un estado de mayor energía a uno con menor energía, y solamente esas frecuencias, no otras. ¿Cómo explicar el hecho de que la energía esté cuantizada?
Pese a estas limitaciones y a que hoy en día existen modelos mucho más sofisticados y acordes a los hechos observados, el modelo atómico de Rutherford todavía es útil para que el estudiante tenga un primer acercamiento exitoso del átomo y sus partículas constituyentes.
En este modelo del átomo no aparece el neutrón, otro constituyente del núcleo, que no fue descubierto sino hasta 1932.
Poco tiempo después de que Rutherford propusiera su modelo planetario, en 1913 el físico danés Niels Bohr lo modificaría para explicar por qué el átomo no se destruye y todavía seguimos aquí para contar esta historia.
Modelo atómico de Schrödinger.
Modelo atómico de Dirac Jordan.
- Rex, A. 2011. Fundamentos de Física. Pearson. 618-621.
- Zapata, F. 2007. Apuntes de clase para la cátedra de Radiobiología y Protección Radiológica. Escuela de Salud Pública de la Universidad Central de Venezuela.
