Modelo atómico de Heisenberg: definición, características y limitaciones
¿Qué es el modelo atómico de Heisenberg?
El modelo atómico de Heisenberg (1927) introduce el principio de incertidumbre en los orbitales de electrones que rodean el núcleo atómico. El destacado físico alemán instauró los cimientos de la mecánica cuántica para estimar el comportamiento de las partículas subatómicas que conforman un átomo.
El principio de incertidumbre de Werner Heisenberg indica que no es posible conocer con certeza la posición y el momento lineal de un electrón al mismo tiempo. El mismo principio aplica para las variables tiempo y energía; es decir, si tenemos un indicio sobre la posición del electrón, desconoceremos el momento lineal del electrón, y viceversa.
En síntesis, no es posible predecir simultáneamente el valor de ambas variables. Lo anterior no implica que no pueda conocerse con precisión alguna de las magnitudes mencionadas previamente. Siempre que sea por separado, no existe ningún impedimento para obtener el valor de interés.
Sin embargo, la incertidumbre tiene lugar cuando se trata de conocer simultáneamente dos magnitudes conjugadas, como es el caso de la posición y el momento lineal, y del tiempo junto a la energía.
Este principio surge debido a un razonamiento estrictamente teórico, como la única explicación viable para dar razón sobre las observaciones científicas.
Características del modelo atómico de Heisenberg

En marzo de 1927 Heisenberg publicó su obra Sobre el contenido perceptivo de la cinemática y la mecánica teóricas cuánticas, donde detalló el principio de incertidumbre o indeterminación.
Este principio, fundamental en el modelo atómico propuesto por Heisenberg, se caracteriza por lo siguiente:
- El principio de incertidumbre surge como una explicación que complementa las nuevas teorías atómicas sobre el comportamiento de los electrones. A pesar de emplear instrumentos de medición con una alta precisión y sensibilidad, la indeterminación sigue estando presente en cualquier ensayo experimental.
- A causa del principio de incertidumbre, al analizar dos variables relacionadas, si se tiene un conocimiento certero de una de estas, entonces la indeterminación sobre el valor de la otra variable será cada vez mayor.
- El momento lineal y la posición de un electrón, u otra partícula subatómica, no se pueden medir al mismo tiempo.
- La relación entre ambas variables viene dada por una inecuación. Según Heisenberg, el producto de las variaciones del momento lineal y de la posición de la partícula siempre es mayor al cociente entre la constante de Plank (6,62606957(29) ×10 -34 Jules x segundos) y 4π, tal como se detalla en la siguiente expresión matemática:
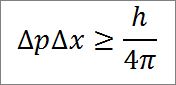
La leyenda correspondiente a esta expresión es la siguiente:
∆p: indeterminación del momento lineal.
∆x: indeterminación de la posición.
h: constante de Plank.
π: número pi 3,14.
- En vista de lo anterior, el producto de las incertidumbres tiene como tope inferior la relación h/4π, que es un valor constante. Por ende, si una de las magnitudes tiende a cero, la otra debe aumentar en la misma proporción.
- Esta relación es válida para todos los pares de magnitudes canónicas conjugadas. Por ejemplo: el principio de incertidumbre de Heisenberg es perfectamente aplicable a la dupla energía-tiempo, tal como se detalla a continuación:
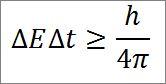
En esta expresión:
∆E: indeterminación de la energía.
∆t: indeterminación del tiempo.
h: constante de Plank.
π: número pi 3,14.
- De este modelo se deduce que el determinismo causal absoluto en variables canónicas conjugadas es imposible, ya que para establecer esta relación se debería tener conocimiento sobre los valores iniciales de las variables de estudio.
- En consecuencia, el modelo de Heisenberg se fundamenta en formulaciones probabilísticas, debido a la aleatoriedad que existe entre las variables a niveles subatómicos.
Pruebas experimentales
El principio de incertidumbre de Heisenberg surge como la única explicación posible a las pruebas experimentales que tuvieron lugar durante las primeras tres décadas del siglo XXI.
Antes de que Heisenberg enunciara el principio de incertidumbre, los preceptos vigentes para entonces sugerían que las variables momento lineal, posición, momento angular, tiempo, energía, entre otras, para las partículas subatómicas se definían operacionalmente.
Esto significaba que eran tratadas como si se tratase de física clásica; es decir, se medía un valor inicial y el valor final se estimaba según el procedimiento preestablecido.
Lo anterior implicaba definir un sistema de referencia para las mediciones, el instrumento de medición y la forma de empleo de dicho instrumento, conforme al método científico.
Según esto, las variables descritas por partículas subatómicas debían comportarse de forma determinística. Esto es, su comportamiento debía predecirse de manera exacta y precisa.
No obstante, cada vez que se realizaba un ensayo de esta naturaleza, resultaba imposible obtener en la medición el valor estimado de forma teórica.
Las medidas se tergiversaban debido a las condiciones naturales del experimento, y el resultado obtenido no era de utilidad para enriquecer a la teoría atómica.
Ejemplo
Por ejemplo: si se trata de medir la velocidad y la posición de un electrón, el montaje del experimento debe contemplar el choque de un fotón de luz con el electrón.
Esta colisión induce una variación en la velocidad y la posición intrínseca del electrón, con lo cual el objeto de la medición es alterado por las condiciones experimentales.
Por ende, el investigador incita a la ocurrencia de un error experimental inevitable, a pesar de la exactitud y precisión de los instrumentos empleados.
Mecánica cuántica distinta de mecánica clásica
Aunado a lo anterior, el principio de indeterminación de Heisenberg enuncia que, por definición, la mecánica cuántica funciona de manera distinta con respecto a la mecánica clásica.
En consecuencia, se da por hecho que el conocimiento preciso de las medidas a nivel subatómico está limitado por la delgada línea que separa a la mecánica clásica y la cuántica.
Limitaciones del modelo de Heisenberg
A pesar de explicar la indeterminación de las partículas subatómicas y sentar las diferencias entre la mecánica clásica y la cuántica, el modelo atómico de Heisenberg no establece una ecuación única para explicar la aleatoriedad de este tipo de fenómenos.
Además, el hecho de que la relación se establezca a través de una inecuación implica que el rango de posibilidades para el producto de dos variables canónicas conjugadas es indeterminado. En consecuencia, la incertidumbre inherente a los procesos subatómicos es significativa.
Artículos de interés
Modelo atómico de Schrödinger.
Modelo atómico de Dirac Jordan.
Referencias
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Recuperado de: britannica.com
- El Principio De Incertidumbre De Heisenberg (s.f.). Recuperado de: hiru.eus
- García, J. (2012). Principio de incertidumbre de Heisenberg. Recuperado de: hiberus.com
- Modelos atómicos (s.f.). Universidad Nacional Autónoma de México. México DF, México. Recuperado de: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.).Recuperado de: the-history-of-the-atom.wikispaces.com
- Wikipedia, La Enciclopedia Libre (2018). Constante de Plank. Recuperado de: es.wikipedia.org
- Wikipedia, La Enciclopedia Libre (2018). Relación de indeterminación de Heisenberg. Recuperado de: es.wikipedia.org
