Alcoholes: estructura, propiedades, nomenclatura y usos
Los alcoholes son compuestos orgánicos que se caracterizan por tener un grupo hidroxilo (-OH) enlazado a un carbono saturado; es decir, un carbono que se encuentra enlazado a cuatro átomos mediante enlaces simples (sin doble ni triple enlaces).
La fórmula genérica para esta vasta y versátil familia de compuestos es ROH. Para que sea considerado como alcohol en un sentido estrictamente químico, el grupo OH debe ser el más reactivo de la estructura molecular. Esto es importante para poder afirmar, entre varias moléculas con grupos OH, cuál de ellas es un alcohol.

Uno de los alcoholes por excelencia y el más conocido en la cultura popular, es el alcohol etílico o etanol, CH3CH2OH. Dependiendo de su procedencia natural, y por ende de su entorno químico, pueden sus mezclas originar un espectro ilimitado de sabores; algunos, que incluso muestran cambios positivos al paladar con el volar de los años.
Son las mezclas de compuestos orgánicos e inorgánicos con alcohol etílico, lo que da pie a su consumo en eventos sociales y religiosos desde tiempos antes de Cristo; tal como ocurre con el vino de uvas, o con las copas servidas para un festejo, además de los ponches, caramelos, panetones, etc.
El disfrute de estas consumiciones, con moderación, es fruto de la sinergia entre el alcohol etílico y su matriz química envolvente; sin ella, como sustancia pura, se vuelve sumamente peligrosa y desencadena una serie de consecuencias negativas para la salud.
Es por esta razón que el consumo de mezclas acuosas de CH3CH2OH, como las que se compran en las farmacias para fines antisépticos, representa un riesgo grande para el organismo.
Otros alcoholes que también son muy populares son el mentol y el glicerol. Este último, así como el eritrol, se encuentra como aditivo en muchos alimentos para endulzarlos y preservarlos durante su almacenamiento. Existen entes gubernamentales que dictaminan cuáles alcoholes pueden ser usados o consumidos sin efectos colaterales.
Dejando atrás el uso cotidiano de los alcoholes, químicamente son sustancias muy versátiles, pues partiendo de ellos, se pueden sintetizar otros compuestos orgánicos; a tal punto que algunos autores piensan que con una docena de ellos se pueden crear todos los compuestos necesarios para vivir en una isla desierta.
Índice del artículo
- 1 Estructura de los alcoholes
- 2 Propiedades físicas y químicas
- 3 Nomenclatura
- 4 Síntesis
- 5 Usos
- 6 Referencias
Los alcoholes tienen una fórmula general de ROH. El grupo OH se encuentra enlazado al grupo alquílico R, cuya estructura varía de un alcohol a otro. La unión entre R y OH es mediante un enlace simple covalente, R-OH.
En la siguiente imagen se muestran tres estructuras genéricas para los alcoholes, teniendo en mente que el átomo de carbono está saturado; es decir, forma cuatro enlaces simples.
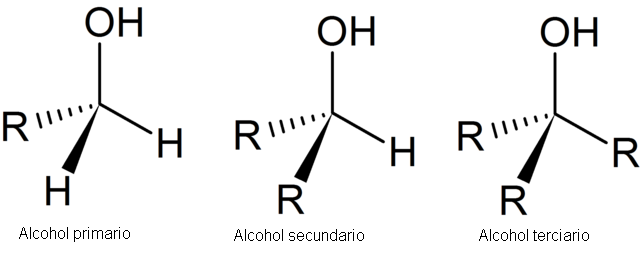
Como se observa, R puede ser cualquier estructura carbonada siempre y cuando no posea sustituyentes más reactivos que el grupo OH.
Para el caso del alcohol primario, 1º, el grupo OH se encuentra enlazado a un carbono primario. Esto se verifica fácilmente observando que el átomo en el centro del tetraedro izquierdo está enlazado a un R y dos H.
El alcohol secundario, 2º, se verifica con el carbono del tetraedro del centro enlazado ahora a dos grupos R y un H.
Y por último, se tiene el alcohol terciario, 3º, con el carbono enlazado a tres grupos R.
Dependiendo del tipo de carbono enlazado al OH, se tiene la clasificación de alcoholes primario, secundario y terciario. En los tetraedros ya se detallaron las diferencias estructurales entre ellos. Pero, todos los alcoholes, sin importar cuál sea su estructura, comparten algo en común: el carácter anfífilo.
No es necesario abordar una estructura para notarlo, sino que basta con su fórmula química ROH. El grupo alquilo se constituye casi en su totalidad de átomos de carbono, “armando” un esqueleto hidrófobo; esto es, que interacciona muy débilmente con el agua.
Por el otro lado, el grupo OH puede formar puentes de hidrógeno con las moléculas de agua, siendo por tanto hidrófílo; esto es, ama o presenta afinidad por el agua. Entonces, los alcoholes tienen un esqueleto hidrofóbico, unido a un grupo hidrofílico. Son apolares y polares a la vez, lo que es igual a decir que son sustancias anfífilas.
R-OH
(Hidrofóbico) – (Hidrofílico)
Como se explicará en el próximo apartado, el carácter anfífilo de los alcoholes define algunas de sus propiedades químicas.
El grupo alquilo R puede tener cualquier estructura, y sin embargo, es importante ya que permite catalogar los alcoholes.
Por ejemplo, R puede ser una cadena abierta, como ocurre con el etanol o propanol; ramificada, como el alcohol t-butílico, (CH3)2CHCH2OH; puede ser cíclica, como en el caso del ciclohexanol; o puede tener un anillo aromático, como en el alcohol bencílico, (C6H5)CH2OH, o en el 3-Fenilpropanol, (C6H5)CH2CH2CH2OH.
La cadena R puede incluso tener sustituyentes como halógenos o dobles enlaces, tales como para los alcoholes 2-cloroetanol y 2-Buten-1-ol (CH3CH2=CHCH2OH).
Considerando entonces la estructura de R, la clasificación de los alcoholes se torna compleja. Por ello la clasificación basada en su estructura (alcoholes 1º, 2º y 3º) es más sencilla pero menos específica, aunque es suficiente para dar explicación a la reactividad de los alcoholes.
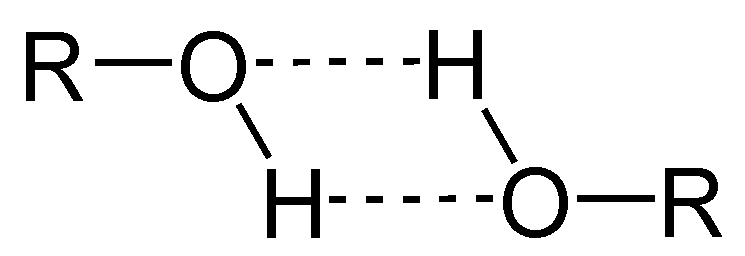
Una de las principales propiedades de los alcoholes es que se asocian a través de puentes de hidrógeno.
En la imagen superior se aprecia cómo dos moléculas de ROH forman puentes de hidrógeno entre sí. Gracias a esto, los alcoholes son líquidos usualmente con puntos de ebullición altos.
Por ejemplo, el alcohol etílico tiene un punto de ebullición de 78,5ºC. Este valor aumenta a medida que se vuelve más pesado el alcohol; esto es, el grupo R posee mayor masa o número de átomos. Así, el alcohol n-butílico, CH3CH2CH2CH2OH, tiene un punto de ebullición de 97ºC, apenas inferior al del agua.
El glicerol es uno de los alcoholes con mayor punto de ebullición: 290ºC.
¿Por qué? Porque no solo influye la masa o estructura de R, sino además el número de grupos OH. El glicerol tiene tres OH en su estructura: (HO)CH2CH(OH)CH2(OH). Esto le hace capaz de formar muchos puentes de hidrógeno y mantener a sus moléculas unidas con mayor fuerza.
Por otra parte, algunos alcoholes son sólidos a temperatura ambiente; como el mismo glicerol a una temperatura inferior a los 18ºC. Por lo tanto, es incorrecta la afirmación de que todos los alcoholes son sustancias líquidas.
En los hogares es muy común recurrir al uso del alcohol isopropílico para remover una mancha difícil de quitar sobre una superficie. Esta capacidad disolvente, de gran utilidad para las síntesis químicas, se debe a su carácter anfífilio, previamente explicado.
Las grasas se caracterizan por ser hidrófobas: por eso resulta difícil removerlas con agua. Sin embargo, a diferencia del agua, los alcoholes poseen una parte hidrofóbica en su estructura.
Así, su grupo alquilo R interactúa con las grasas, mientras que el grupo OH forma puentes de hidrógeno con el agua, ayudando a desplazarlas.
Los alcoholes pueden reaccionar como ácidos y bases; es decir, son sustancias anfóteras. Esto se representa con las siguientes dos ecuaciones químicas:
ROH + H+ => ROH2+
ROH + OH– => RO–
El RO– es la fórmula general de lo que se conoce como un alcóxido.
Existen dos maneras de nombrar a los alcoholes, cuya complejidad dependerá de la estructura de los mismos.
A los alcoholes se les puede llamar por sus nombres comunes. ¿Cuáles son? Para ello, debe conocerse el nombre del grupo R, al cual se le añade la terminación –ico, y es antecedido por la palabra ‘alcohol’. Por ejemplo, el CH3CH2CH2OH es el alcohol propílico.
Otros ejemplos son:
-CH3OH: alcohol metílico
-(CH3)2CHCH2OH: alcohol isobutílico
-(CH3)3COH: alcohol tert-butílico
Al igual que para los nombres comunes, debe comenzarse por identificar R. La ventaja de este sistema es que es mucho más preciso que el otro.
R, al tratarse de un esqueleto carbonado, puede tener ramificaciones o varias cadenas; la cadena más larga, esto es, con más átomos de carbono, es a la que se le adjudicará el nombre del alcohol.
Al nombre del alcano de la cadena más larga, se le adiciona la terminación ‘l’. Es por eso que al CH3CH2OH se le llama etanol (CH3CH2– + OH).
Generalmente, el OH debe tener la menor enumeración posible. Por ejemplo, el BrCH2CH2CH2(OH)CH3 se llama 4-Bromo-2-butanol, y no 1-Bromo-3-butanol.
El proceso de craking del petróleo produce una mezcla de alquenos de cuatro o cinco átomos de carbono, los cuales pueden separarse fácilmente.
Estos alquenos pueden convertirse en alcoholes por la adición directa de agua o por la reacción del alqueno con ácido sulfúrico, seguida por la adición del agua que escinde el ácido, originando el alcohol.
En presencia de un catalizador adecuado, los alquenos reaccionan con el monóxido de carbono e hidrógeno para generar aldehídos. Los aldehídos pueden reducirse fácilmente a alcoholes mediante una reacción de hidrogenación catalítica.
A menudo hay una sincronización tal del proceso oxo que la reducción de los aldehídos es casi simultánea con su formación.
El catalizador más usado es el octocarbonil dicobalto, obtenido por la reacción entre el cobalto y el monóxido de carbono.
La fermentación de carbohidratos por la levadura es todavía de gran importancia en la producción de etanol y otros alcoholes. Los azúcares provienen de la caña de azúcar o del almidón obtenido de diferentes granos. Por esta razón, el etanol es llamado también el “alcohol de grano”
Si bien no es la función principal de los alcoholes, la presencia de etanol en algunas de las bebidas es de la de mayor conocimiento popular. Así, el etanol, producto de la fermentación de la caña de azúcar, de la uva, de la manzana, etc., está presente en numerosas bebidas de consumo social.
-El metanol se utiliza en la producción de formaldehido, mediante su oxidación catalítica. El formaldehido es usado en manufactura de plásticos, pinturas, textiles, explosivos, etc.
-El butanol se utiliza en la producción de butano etanoato, un éster utilizado como saborizante en la industria alimenticia y en confitería.
-El alcohol alílico se utiliza en la producción de ésteres, entre ellos el ftalato de dialilo y el isoftalato de dialilo, los cuales sirven de monómeros.
-El fenol se usa en la producción de resinas, manufactura de nylon, desodorantes, cosméticos, etc.
-Los alcoholes con cadena lineal de 11-16 átomos de carbonos son usados como intermediarios para lo obtención de plastificantes; por ejemplo, el cloruro de polivinilo.
-Los llamados alcoholes grasos son usados como intermediarios en la síntesis de detergentes.
-El metanol se usa como disolvente de pinturas, al igual que 1-butanol y alcohol isobutílico.
-El alcohol etílico se usa como solventes de muchos compuestos insolubles en el agua, utilizándose como solvente en pinturas, cosméticos, etc.
-Los alcoholes grasos se usan como disolventes en la industria textil, en colorantes, en detergentes y en pinturas. El isobutanol se usa como disolvente en material de revestimiento, pinturas y adhesivos.
-El metanol se utiliza como combustible en los motores de combustión interna y aditivo de la gasolina para mejorar la combustión.
-El alcohol etílico es usado en combinación con los combustibles fósiles en los vehículos automotores. Para ese fin, extensas regiones de Brasil son destinadas al cultivo de la caña de azúcar para la producción de alcohol etílico. Este alcohol tiene la ventaja de producir en su combustión solo dióxido de carbono.
Cuando se quema el alcohol etílico produce una llama limpia y sin humo, razón por la cual es usada como combustible en cocinillas de campaña.
-El alcohol gelificado se produce por combinación del metanol o del etanol con acetato de calcio. Este alcohol se usa como fuente de calor en las estufas de campaña, y como se derrama es más seguro que los alcoholes líquidos.
-El llamado biobutanol es usado como combustible en el transporte, al igual que el alcohol isopropilico que puede usarse como combustible; aunque su uso no es recomendado.
El alcohol isopropílico al 70% de concentración es usado como antiséptico externo para la eliminación de gérmenes y retardo de su crecimiento. Igualmente el alcohol etílico es usado con este fin.
El ciclohexanol y el metilciclohexanol son usados en el acabado de textiles, procesados de muebles y quitamanchas.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Dr. JA Colapret. (s.f.). Alcohols. Recuperado de: colapret.cm.utexas.edu
- The Alcohol Pharmacology Education Partnership. (s.f.). What is alcohol? Duke University. Recuperado de: sites.duke.edu
- Whittemore F. (s.f.). Types & uses of alcohol. Recuperado de: livestrong.com
- Wikipedia. (2018). Alcohol. Recuperado de: en.wikipedia.org
