Alcohol isopropílico: estructura, propiedades, síntesis y usos
El alcohol isopropílico o isopropanol es un compuesto orgánico cuya fórmula química es CH3CHOHCH3 o (CH3)2CHOH. Pertenece a una de las familias más importantes de la química orgánica: los alcoholes, tal como su nombre lo indica.
Es un compuesto químico líquido, incoloro, de fuerte olor, volátil e inflamable. Es un ácido y base débil a la vez, similar al agua, dependiendo del pH de la solución y/o a la presencia de un ácido o una base más fuertes que él. Los vapores del alcohol isopropílico causan irritación muy leve en la mucosa de nariz, garganta y de los ojos.

El alcohol isopropílico se emplea como ingrediente principal de varios productos de la industria farmacéutica, química, comercial y de uso doméstico. Por sus propiedades antimicrobianas es ampliamente usado como antiséptico sobre la piel y mucosas, y como desinfectante en materiales inertes.
Es muy útil como solvente, ya que tiene una baja toxicidad, y además es utilizado como aditivo de la gasolina.
Asimismo, es la materia prima para la síntesis de otros compuestos orgánicos al sustituir el grupo funcional hidroxilo (OH). De esta manera, este alcohol es muy útil y versátil para obtener otros compuestos orgánicos; como alcóxidos, halogenuros de alquilo, entre otros compuestos químicos.
Índice del artículo
- 1 Estructura del alcohol isopropílico o isopropanol
- 2 Propiedades físicas y químicas
- 3 Nomenclatura
- 4 Síntesis
- 5 Usos
- 6 Referencias
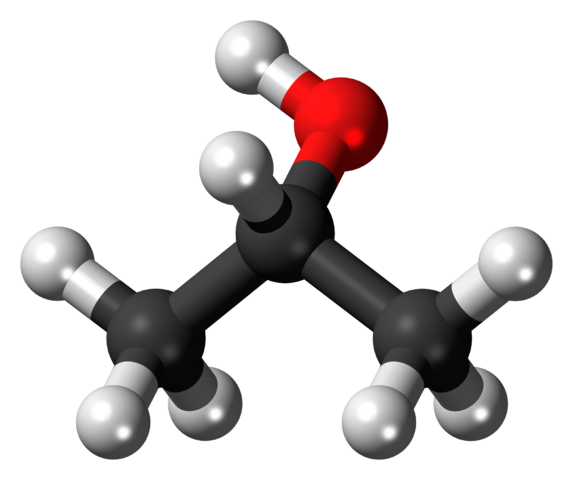
En la imagen superior se muestra la estructura del alcohol isopropílico o isopropanol con un modelo de esferas y barras. Las tres esferas grises representan los átomos de carbono, los cuales componen el grupo isopropilo, unido a un hidroxilo (esferas roja y blanca).
Como todos los alcoholes, estructuralmente están formados por un alcano; en este caso, el propano. Este le da al alcohol la característica de lipófilo (capacidad de disolver las grasas dado su afinidad por ellas). Está unido a un grupo hidroxilo (-OH), el cual por otro lado le confiere a la estructura la característica de hidrófilo.
Por lo tanto, el alcohol isopropílico puede disolver las grasas o manchas. Nótese que el grupo -OH se encuentra enlazado al carbono del medio (2°, es decir, unido a otros dos átomos de carbono), lo que demuestra que este compuesto se trata de un alcohol secundario.
Su punto de ebullición es inferior al del agua (82,6°C), lo que puede explicarse a partir del esqueleto de propano, los cuales apenas pueden interactuar unos con otros mediante fuerzas de dispersión de London; inferiores respecto a los puentes de hidrógeno (CH3)2CHO-H — H-O-CH(CH3)2.
60,10 g/mol.
Líquido e incoloro e inflamable.
Olor fuerte
-89 °C.
82,6 °C.
0,786 g/ml a 20 °C.
Es soluble en agua y soluble en compuestos orgánicos como cloroformo, benceno, etanol, glicerina, éter y acetona. Es insoluble en soluciones salinas.
17
(CH3)2CHO–
El alcohol isopropílico en el espectro ultravioleta visible posee una absorbancia máxima a 205 nm.
En la nomenclatura de los compuestos orgánicos, existen dos sistemas: el de nombres comunes, y el sistema estandarizado internacionalmente IUPAC.
Alcohol isopropílico se corresponde al nombre común, termina en el sufijo -ico, precedido de la palabra alcohol y con el nombre del grupo alquilo. El grupo alquilo esta constituido por 3 átomos de carbono, dos extremos metil y el del centro unido al grupo -OH; es decir, grupo isopropilo.
El alcohol isopropílico o isopropanol tiene otros nombres como 2-propanol, alcohol-sec-propilico, entre otros; pero según la nomenclatura IUPAC, se denomina propano-2-ol.
Según esta nomenclatura, primero es ‘propano’ porque la cadena carbonada contiene o está formada por tres átomos de carbono.
En segundo lugar, se indica en la cadena carbonada la posición del grupo OH utilizando un número; en este caso es 2.
El nombre termina en ‘ol’, característica de los compuestos orgánicos de la familia de los alcoholes por contener el grupo hidroxilo (-OH).
El nombre de isopropanol es considerado como incorrecto por la IUPAC, debido a la inexistencia del hidrocarburo isopropano.
La reacción química de síntesis del alcohol isopropílico a nivel industrial es básicamente una reacción de adición de agua; es decir, de hidratación.
El producto de partida para la síntesis u obtención es el propeno, al cual se le adiciona agua. El propeno CH3-CH=CH2 es un alqueno, hidrocarburo derivado del petróleo. Por hidratación se sustituye un hidrógeno (H) por un grupo hidroxilo (OH).
El agua es agregada al alqueno propeno en presencia de ácidos, para producir así el alcohol isopropanol.
Existen dos vías para realizar su hidratación: la directa, y la indirecta realizada en condiciones polares generando el isopropanol.
CH3-CH=CH2 (Propeno) => CH3CHOHCH3 (Isopropanol)
En la hidratación directa, en fase gaseosa o líquida, el propeno es hidratado por catálisis ácida a elevada presión.
En la hidratación indirecta, el propeno reacciona con ácido sulfúrico, formando esteres de sulfato que por hidrólisis producen el alcohol isopropílico.
También el alcohol isopropílico se obtiene mediante la hidrogenación de la acetona en fase líquida. Estos procesos van seguidos de destilación para separar el alcohol del agua, generando alcohol isopropílico anhidro con un rendimiento de 88% aproximadamente.
El alcohol isopropílico tiene una amplia gama de usos a nivel químico. Es útil para elaborar otros compuestos químicos. Tiene numerosas aplicaciones a nivel industrial, para limpieza de equipos, a nivel medico, en productos del hogar y de uso cosmético.
Este alcohol se usa en perfumes, tintes para el cabello, lacas, jabones, entre otros productos como se vera a continuación. Su uso es principal y básicamente externo, ya que resulta muy toxica su inhalación o ingestión para los seres vivos.
A partir de él se pueden obtener halogenuros de alquilo al sustituir generalmente por bromo (Br) o cloro (Cl), el grupo funcional alcohol (OH).
Realizando un proceso de oxidación del alcohol isopropilico con el ácido crómico, se puede dar origen a la acetona. Puede formar alcóxidos como resultado de la reacción del alcohol isopropílico con algunos metales como el potasio.
El alcohol isopropílico resulta ideal para la limpieza y mantenimiento de cristales ópticos como lentes y equipos electrónicos, entre otros. Este alcohol se evapora rápidamente, no deja residuos o trazas, y no presenta toxicidad en sus aplicaciones o uso externo.
El isopropanol tiene propiedades antimicrobianas, ocasiona la desnaturalización de las proteínas bacterianas, disuelve las lipoproteínas de la membrana celular, entre otros efectos.
Como antiséptico, el alcohol isopropílico se aplica sobre la piel y mucosas y se evapora rápidamente, dejando un efecto de enfriamiento. Es usado para realizar cirugías menores, inserción de agujas, catéteres, entre otros procedimientos invasivos. Además, se emplea como desinfectante de instrumentos médicos.
A parte de su uso como antimicrobiano, es requerido en los laboratorios para limpieza, conservación de muestras, y extracción del ADN.
También este alcohol resulta muy útil en la elaboración de productos farmacológicos. El alcohol isopropílico se mezcla con fragancias y aceites esenciales, y se emplea en los compuestos terapéuticos para frotar en el cuerpo.
El alcohol isopropilico tiene la propiedad de disolver algunos aceites, resinas naturales, gomas, alcaloides, etilcelulosa, entre otros compuestos químicos.
- Carey, F. A. (2006). Química Orgánica Sexta Edición. Editorial Mc Graw Hill
- Morrison, R. y Boyd, R. (1990). Química Orgánica. Quinta Edición. Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Isopropyl alcohol. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Isopropyl alcohol. Recuperado de: en.wikipedia.org
- Wade, L. (05 de abril de 2018). Isopropyl alcohol. Encyclopaedia Britannica. Recuperado de: britannica.com
