Alcohol etílico: estructura, propiedades, usos, obtención
El alcohol etílico o etanol es un compuesto orgánico cuya fórmula es C2H5OH o CH3CH2OH, presentándose como un líquido incoloro. Se trata del segundo alcohol primario más simple de todos después del metanol. Es muy soluble en agua y en muchos solventes orgánicos, lo cual ha permitido el desarrollo de muchas de sus aplicaciones.
Este alcohol se ha utilizado como antiséptico y desinfectante, además de su uso en la síntesis de medicinas y otros productos químicos orgánicos. Asimismo, ha sido empleado como combustible en calentadores, lámparas, y en combinación con la gasolina en vehículos automotores.
La fermentación del azúcar para la producción de etanol es una de las primeras reacciones químicas que aprendió el hombre primitivo. Se ha encontrado en China una cerámica de 9000 años de antigüedad que contenía restos secos de etanol, indicando que el hombre del Neolítico ya consumía alcohol.
Pero la fermentación de azúcares solamente producía una solución de etanol de muy baja concentración, razón por la cual fue necesario aprender técnicas de destilación para eliminar el agua y concentrar el alcohol. Así, alquimistas griegos que trabajaban en Alejandría en el siglo I d.C., ya conocían y usaban la destilación.
No obstante, existen rutas sintéticas que permiten obtener etanol totalmente puro partiendo del etileno, el cual se destila del petróleo. Por lo tanto, el petróleo es una fuente indirecta de etanol. De esta manera se obtiene etanol o alcohol absoluto.
Índice del artículo
- 1 Estructura del alcohol etílico
- 2 Propiedades
- 2.1 Apariencia física
- 2.2 Masa molar
- 2.3 Olor
- 2.4 Sabor
- 2.5 Densidad
- 2.6 Punto de fusión
- 2.7 Punto de ebullición
- 2.8 Solubilidad en agua
- 2.9 Miscibilidad con solventes orgánicos
- 2.10 Coeficiente de partición octanol/agua
- 2.11 Presión de vapor
- 2.12 Densidad de vapor
- 2.13 Punto de ignición
- 2.14 Temperatura de autoignición
- 2.15 Calor de combustión
- 2.16 Combustión
- 2.17 Calor específico
- 2.18 Viscosidad
- 2.19 Índice de refracción ηD
- 3 Usos del alcohol etílico
- 4 Obtención del alcohol etílico
- 5 Toxicidad y riesgos
- 6 Referencias
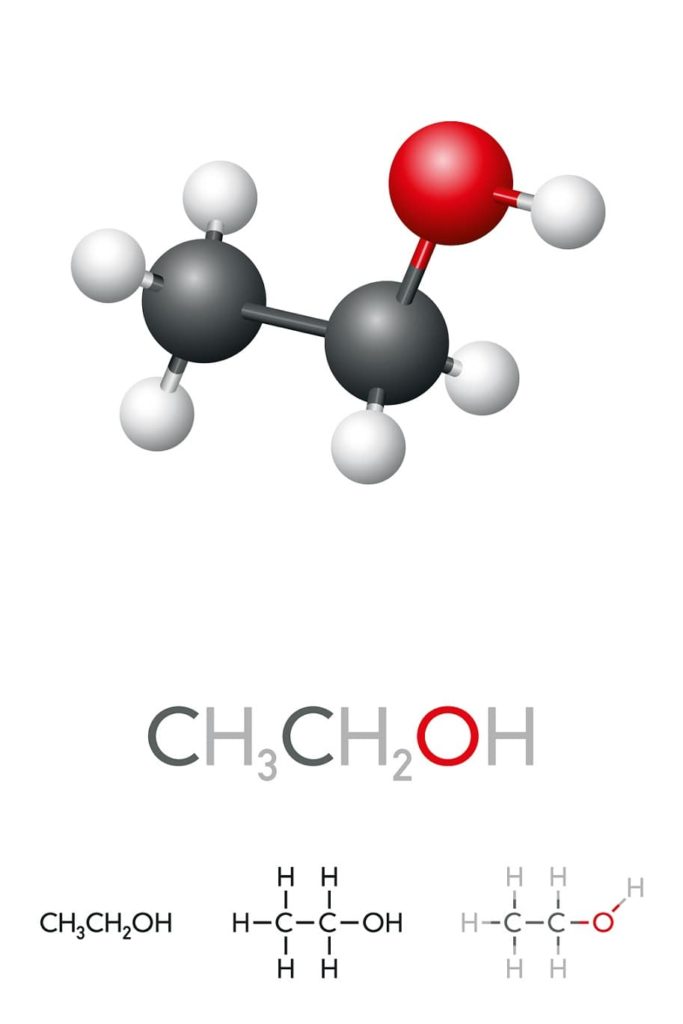
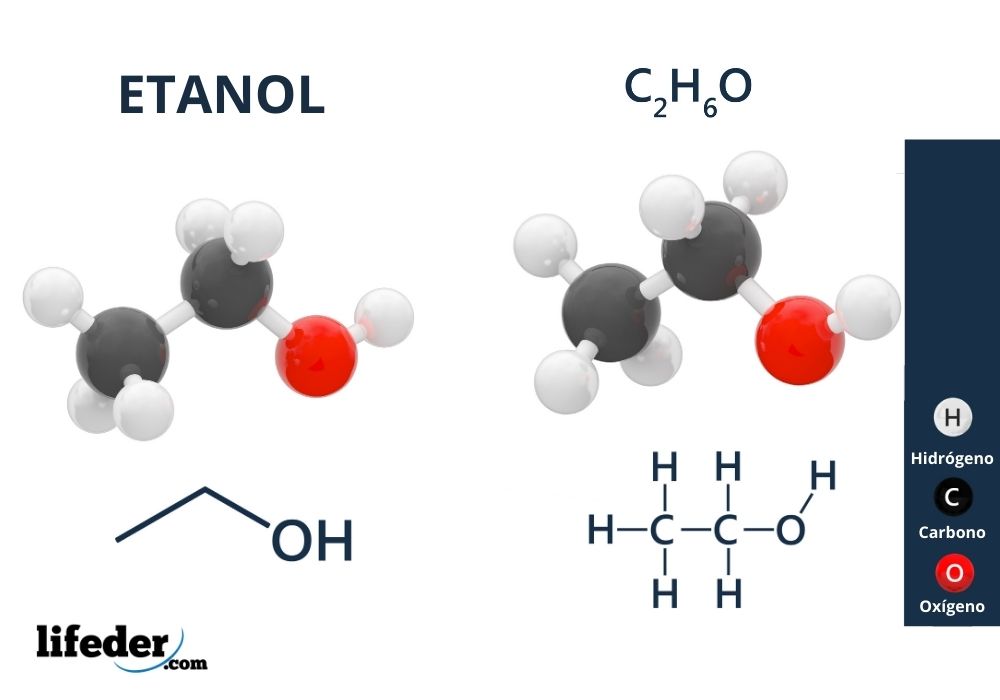
En la imagen superior tenemos la estructura molecular del etanol, CH3-CH2-OH, representada por un modelo de espacio lleno. Es una molecular bastante polar, pues el grupo OH atrae densidad electrónica hacia sí del esqueleto carbonado al cual está enlazado.
Como resultado, las moléculas del alcohol etílico interaccionan mediante fuerzas dipolo-dipolo, sobresaliendo las de tipo puentes de hidrógeno, CH3CH2OH—OHCH2CH3. Es por eso que este alcohol presenta un alto punto de ebullición en comparación a otros solventes o líquidos orgánicos.
Líquido incoloro.
46.069 g/mol
Olor suave y parecido al del vino.
Quemante.
0.789 g/cm3 a 20 ºC
– 114,14 ºC
78,24 ºC
1·106 mg/L. Es decir, es prácticamente miscible en todas proporciones.
El etanol es miscible con el ácido acético, la acetona, el benceno, el tetracloruro de carbono, el cloroformo, el éter dietílico, el etilenglicol, el glicerol, la piridina y el tolueno. También es miscible con hidrocarburos alifáticos ligeros, tales como el pentano y hexano.
Log P = – 0.31
59.3 mm Hg a 25 ºC. Por lo tanto, despide una perceptible cantidad de vapores.
1.59 en relación al aire tomado como la unidad (1)
13 ºC
363 ºC
1336.8 kJ/mol a 25 ºC
El etanol es un líquido volátil que arde con una llama azul, sin humo, y que es prácticamente invisible a la luz natural.
0.618 cal/g a 23 ºC
1.2 mPa·s a 20 ºC
1.3611

Antiséptico
El etanol se usa como antiséptico, ya que tiene una acción letal contra bacterias y hongos. Es capaz de alterar la estructura de sus membranas plasmáticas, lo cual produce su destrucción mediante los flujos osmóticos de agua que se establecen.
Asimismo, el etanol puede destruir muchos tipos de virus. En el momento actual se recomienda el uso de geles que contienen alcohol para desinfectar las manos y reducir el contagio con el coronavirus. También se usa el etanol en la desinfección de heridas leves superficiales.
Solvente de fármacos
Muchos medicamentos son poco solubles en agua, usándose etanol para aumentar su solubilidad. Algunos jarabes para la tos y enjuagues bucales tienen un contendido de etanol de hasta un 25%.
Tratamiento del dolor
Se usa el etanol para la lisis terapéutica de nervios o ganglios para el alivio del dolor crónico intratable, presente en un cáncer inoperable o en una neuralgia del trigémino.
Tratamiento de quistes tiroideos sintomáticos
Se usan inyecciones percutáneas de etanol en el tratamiento de los quistes tiroideos, procedimiento sencillo que pudiera evitar las complicaciones de una intervención quirúrgica.
Acción sedante
Ocasionalmente, el etanol es administrado en forma intravenosa para la sedación preoperatoria y postoperatoria, en aquellos pacientes a quienes otras medidas no son utilizables.
Antídoto
El etanol es usado por vía sistémica para el tratamiento de intoxicaciones con metanol o etilenglicol.
Glaucoma
El etanol se utiliza para reducir la presión intraocular en pacientes con glaucoma.
Estados Unidos, junto a Brasil, consume el 90% del etanol usado como combustible en automóviles. Los Estados Unidos es el mayor productor de maíz en el mundo, por lo que utiliza el maíz como fuente de etanol como combustible.
El gobierno subsidió a los cultivadores de maíz, lo cual hizo aumentar entre los años 1979 y 1986 la producción de etanol de uso combustible de 20 millones de galones por año a 750 millones de galones.
La caña de azúcar es la fuente principal de etanol de Brasil para su uso como combustible. En 1943, debido a la segunda guerra mundial en la que se dificultaba el ingreso de petróleo a Brasil, aumentó considerablemente el uso del etanol como combustible.
Desde 1976 se usan como combustible en automóviles mezclas de etanol y gasolina, cuyo contenido de etanol oscila entre un 10 y un 25 %, dependiendo de la producción de caña de azúcar.
El etanol está presente en numerosas bebidas usadas en reuniones sociales e inclusive durante el almuerzo y la cena familiar.
La acción inicial del alcohol de desinhibir la conducta social de la persona produce un ambiente agradable y facilitador de la interacción entre las personas. Sin embargo, el exceso de etanol puede detonar efectos tóxicos e indeseables en la salud personal y en la armonía entre reuniones o eventos.
El etanol está presente en muchos cosméticos y productos de belleza. Además, debido a su acción astringente se usa en la limpieza de piel, eliminando restos de grasa y sucio que no lo hacen el agua y el jabón. Asimismo forma parte de la preparación de muchas lociones y perfumes.
La esencia de vainilla, un saborizante de uso en tortas y pasteles, está disuelta en una mezcla de etanol y agua. Se venden caramelos que se encuentran rellenos de ciertas bebidas alcohólicas. También se emplea el alcohol como saborizante de algunos dulces.
El etanol se obtiene principalmente por fermentación de azúcares e hidratación del etileno, haciéndose ensayos para producirlo a partir de dióxido de carbono, lípidos y celulosa.
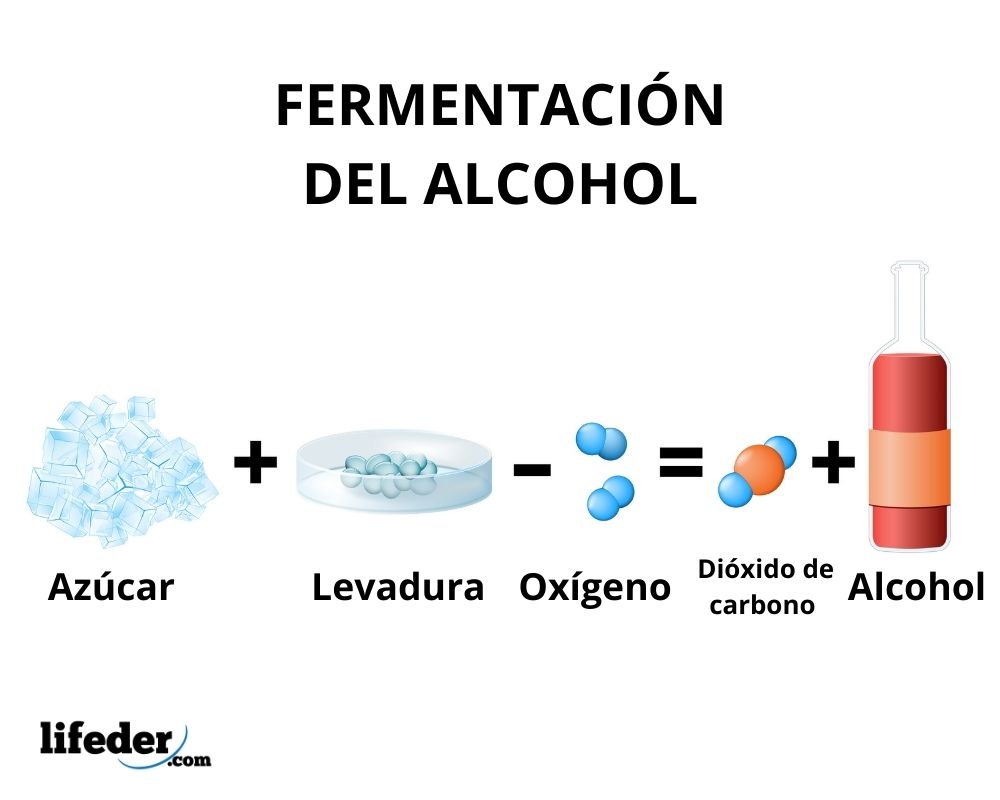
En el proceso de fermentación ocurre la transformación de carbohidratos en etanol por la acción de enzimas presentes en la levadura. Principalmente se utiliza como materia prima la caña de azúcar, la remolacha, y los cereales como el maíz y la cebada.
Las enzimas de la glucólisis de algunas especies de levadura, como la Saccharomyces cerevisiae, son capaces de actuar sobre los azúcares glucosa y sacarosa, para así producir etanol. La concentración del etanol producido se ve limitada por la susceptibilidad de las levaduras al etanol.
En todo caso, la concentración del etanol producido por fermentación no supera el 18%. Es necesario pues, concentrarse la solución de etanol utilizando la destilación simple. Mediante este método se obtiene una solución de etanol con una concentración alrededor del 95%.
Finalmente, se utiliza la destilación fraccionada y la deshidratación del alcohol del 95% para la producción de alcohol absoluto. El etanol producido por fermentación es empleado en medicina, y se reserva como un combustible que complementa la gasolina.
En este proceso el etileno se mezcla con vapor de agua desionizada a altas temperaturas, entre 250 y 300 ºC, y bajo una presión de 6.8 MPa. La conversión del etileno a etanol es catalizada por el ácido fosfórico colocado sobre un lecho de gel de sílice o tierra diatomeas.
La reacción de hidratación del etileno puede ser esquematizada en la forma siguiente:
C2H4 + H2O → CH3CH2OH
Parte del ácido fosfórico es arrastrado por el vapor de agua y debe ser neutralizado con hidróxido de sodio diluido. La concentración del etanol obtenido por hidratación del etileno es baja, con un valor entre el 10 y el 25%.
Luego, la solución de etanol se concentra mediante destilación, obteniéndose una solución de etanol al 95%, que puede ser llevada al 100% mediante destilación fraccionada y deshidratación.
De los métodos alternativos para la producción de etanol tenemos el uso del dióxido de carbono, lípidos y celulosa. El empleo de la celulosa resulta más prometedor, ya que se pueden utilizar materiales como madera, paja, papeles de desechos, etc., como fuente de la materia prima celulosa. La celulosa es un polímero de glucosa y puede ser utilizada como fuente de este carbohidrato.

Las altas concentraciones de vapor de etanol pueden causar somnolencia, irritación de los ojos y del tracto respiratorio superior, manifestado por tos y dolor de cabeza.
El contacto con la piel puede producir resequedad y, en forma crónica, irritación y dermatitis. Mientras, el contacto con los ojos produce irritación, enrojecimiento, dolor y sensación de quemadura.
Produce una sensación quemante y al principio tiene una acción estimulante y agradable por la desinhibición producida. Pero al continuar la ingesta de alcohol, se produce una depresión nerviosa, dolor de cabeza, visión borrosa, somnolencia e inconsciencia.
El etanol afecta el sistema nervioso central y el tracto respiratorio superior. Además, el daño hepático producido por la ingestión de etanol puede llevar a una cirrosis y, posteriormente, a la muerte.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Ethanol. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Ethanol. PubChem Compound Summary for CID 702. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Ethanol History. (2011). Ethanol History – From Alcohol to Car Fuel. Recuperado de: ethanolhistory.com
- The Editors of Encyclopaedia Britannica. (2020). Ethanol. Recuperado de: britannica.com
- Corquiven. (15 de octubre de 2000). Hoja de seguridad (MSDS) Alcohol Etílico. [PDF]. Recuperado de: iio.ens.uabc.mx
- Byju’s. (2020). Uses of Methanol and Ethanol. Recuperado de: byjus.com
- Helmenstine, Anne Marie, Ph.D. (25 de agosto de 2020). The Difference Between Alcohol and Ethanol. Recuperado de: thoughtco.com
