Enlace por puente de hidrógeno: características, ejemplos
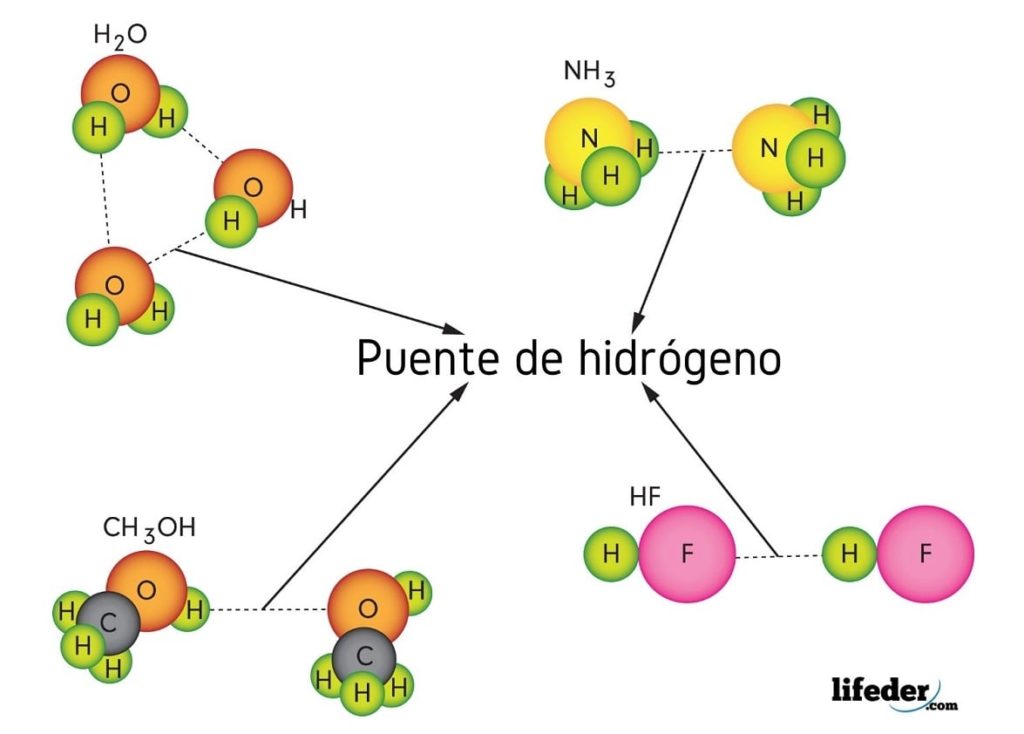
¿Qué es un enlace por puente de hidrógeno?
El enlace por puente de hidrógeno es un tipo especial de interacción dipolo-dipolo, perteneciente a las fuerzas de Van der Waals, en el cual un átomo de hidrógen une a dos o más moléculas sin que se enlacen covalentemente. No se habla de un compartimiento de electrones, sino de un fenómeno principalmente electrostático.
Como su nombre sugiere, el hidrógeno actúa como puente, por lo que debe situarse entre dos átomos. El hidrógeno se encuentra enlazado (H-X) a un átomo muy electronegativo (tales como N, O y F), y se aproxima a otro átomo electronegativo pero de una molécula vecina. Esto da lugar a la formación del puente de hidrógeno X···H-X.
Nótese que en la representación X···H-X, los puntos simbolizan el puente de hidrógeno, mientras que el guión representa el enlace covalente entre H y X. Dicho esto, veamos el puente de hidrógeno entre dos moléculas de agua, donde X es el átomo de oxígeno: H2O···H-OH (imagen inferior).
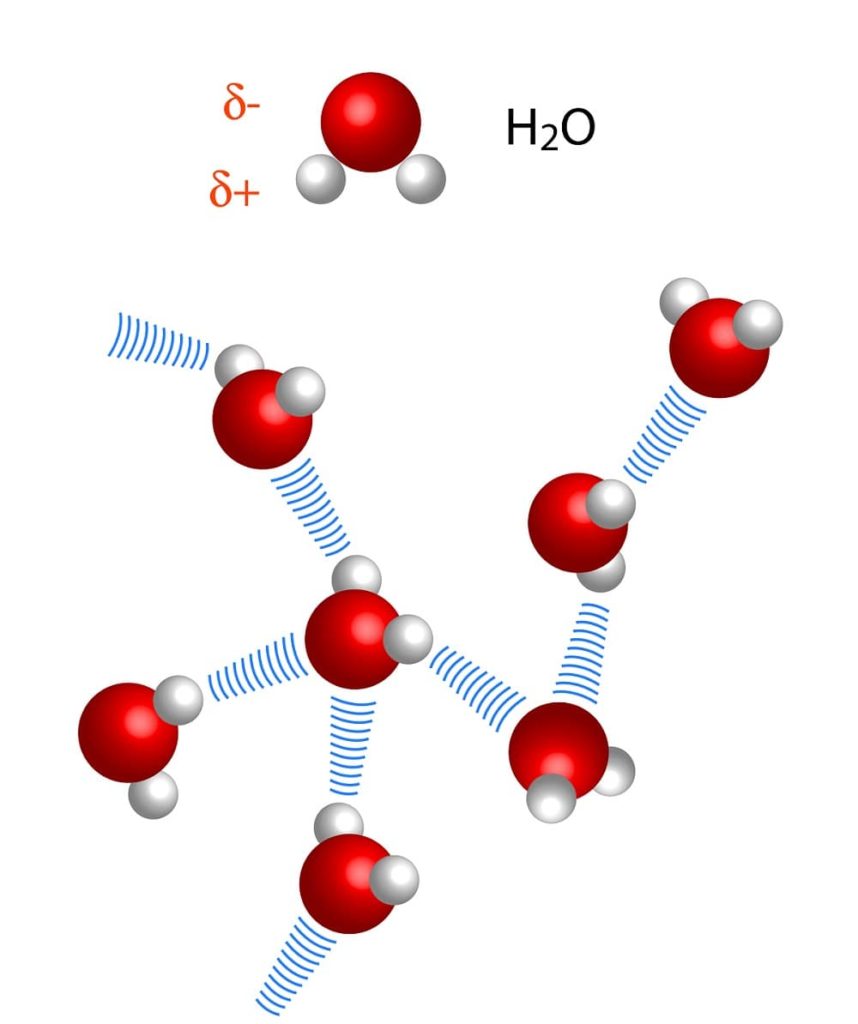
En la imagen de arriba vemos que siete moléculas de agua se mantienen unidas gracias a sus puentes de hidrógeno, representados por líneas azules. Un puente de hidrógeno por sí solo no es muy fuerte, pero cuando hay miles de millones de ellos, otorgan a la materia propiedades anormales e inesperadas.
Características del puente de hidrógeno
Composicionales
El puente de hidrógeno realmente debería representarse como X’···H-X, donde X es lo que se conoce como el donador del puente de hidrógeno, porque está enlazado covalentemente al hidrógeno (lo da).
Mientras, X’ es el aceptor del puente de hidrógeno, presente en una molécula vecina (lo recibe). Así, tenemos un átomo donador (X), un hidrógeno (H) y un átomo aceptor (X’) componiendo el puente de hidrógeno (X’···H-X).
Geométricas
Cuando pensamos en un puente nos vienen a la cabeza superficies planas o arqueadas. Debido a que se asume que los enlaces no se curvan, tendremos entonces dos distancias: X···H y H-X, las cuales conforman el puente de hidrógeno X···H-X.
Entre esas dos distancias existe un ángulo, el cual muchas veces es 180 º; es decir, que los tres átomos de nuestro puente descansan en una misma línea horizontal (o vertical).
Cuando el ángulo es diferente de 180º, el puente X···H-X ya no es recto o lineal, sino que adquiere otras geometrías.
Por otro lado, las distancias en los puentes de hidrógeno no son idénticas. La distancia H-X es más corta que X···H, lo cual puede observarse en la imagen de las moléculas de agua. Así por ejemplo, la distancia H-X suele ser de 110 pm (1·10-12m), mientras que la otra distancia X···H es de 160 pm en adelante.
Asociativas
Una característica especial del puente de hidrógeno es que permite que las moléculas se asocien mucho más entre sí. No andan de un lado a otro ignorándose mutuamente. Por lo tanto, establece un orden momentáneo en los senos de los líquidos; y en el caso de los sólidos, contribuyen en la definición de sus cristales.
Donde veamos un puente de hidrógeno podemos pensar en asociación y, por ende, en un cierto orden (aunque dinámico y cambiante) a escalas moleculares.
Energéticas
Romper un puente de hidrógeno no es muy difícil. Las moléculas de agua, por ejemplo, los andan rompiendo y creando a cada rato mientras se movilizan. Pero romper muchos de ellos al mismo tiempo implicaría desasociar a un número interminable de moléculas. Hablamos de suministrar una energía tal que rompa moles de dichos puentes de hidrógeno (6.02·1023 X···H-X).
Así, la fuerza del puente de hidrógeno varía dependiendo de las identidades y naturaleza de las moléculas. Por ejemplo, la fuerza del puente de hidrógeno O···H-O entre el agua y el alcohol es de 5 kcal/mol: se necesita 5 kcal de energía para romper un mol de ese puente de hidrógeno en cuestión.
Ejemplos de puentes de hidrógeno
Agua
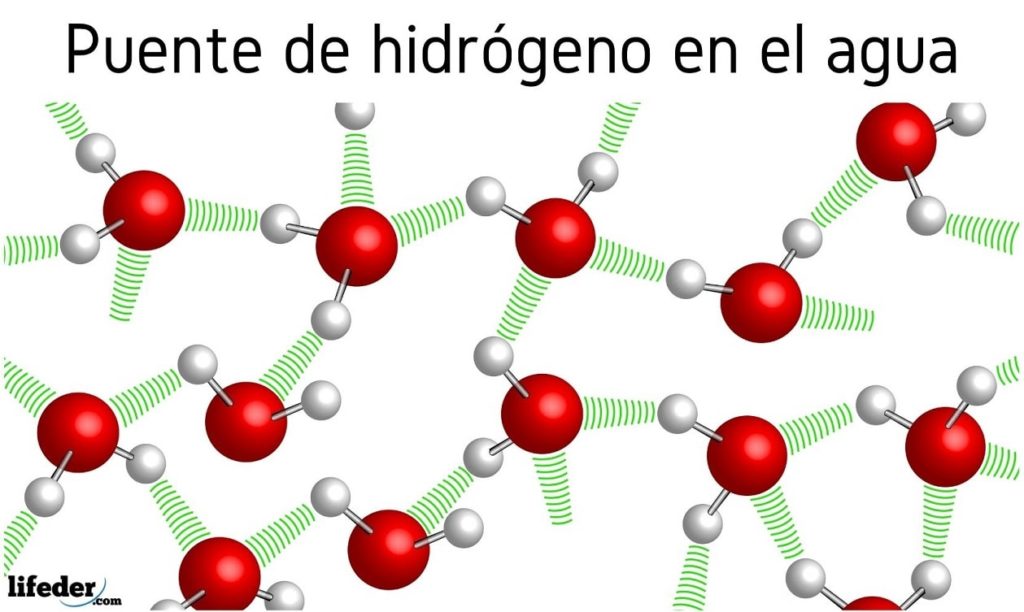
Al principio se habló de los puentes de hidrógeno entre las moléculas de agua, pero no se mencionó el efecto que tiene en sus propiedades. Gracias a ellos el agua hierve a 100 ºC, dejando muy atrás los puntos de ebullición de moléculas afines como el H2S, que hierve a -60 ºC; o el H2Se, que hierve a -41.25 ºC.
Esta abismal diferencia se debe a los puentes de hidrógeno del agua, los cuales también definen otras de sus propiedades anómalas, como su enorme calor específico, los cristales del hielo, su constante dieléctrica, etc.
Etanol
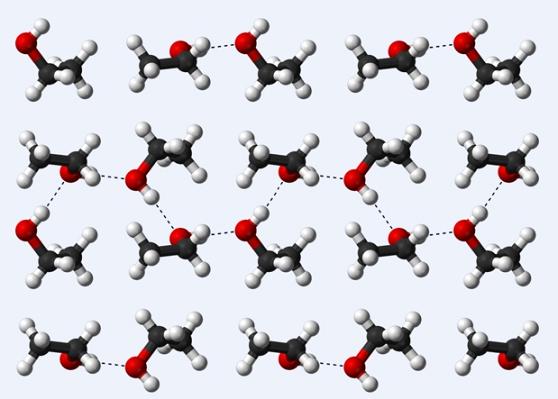
Ahora veamos otro puente de hidrógeno: el que existe entre las moléculas de etanol, CH3CH2OH (arriba). Nótese cómo se acomodan las moléculas CH3CH2OH de tal forma que se establecen sus puentes de hidrógeno CH3CH2HO···HOCH2CH3 (líneas punteadas).
Sin embargo, las moléculas están demasiado ordenadas para suponer que hablamos del etanol líquido, sino que en su lugar componen un cristal (etanol sólido).
El puente de hidrógeno descrito para el etanol es similar al de los otros alcoholes, con la diferencia de que sus esqueletos carbonados pueden entorpecer la eficiencia de dichos puentes.
Ácido acético
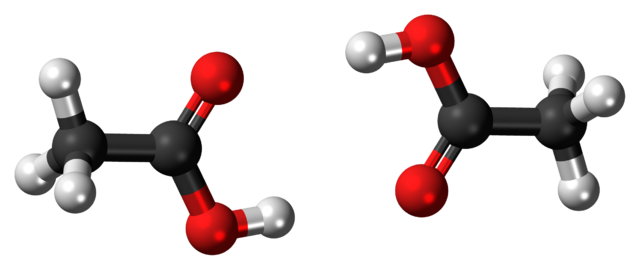
El ácido acético, CH3COOH, es capaz de establecer al mismo tiempo dos puentes de hidrógeno que unen a dos moléculas a la vez. Debido a que son dos moléculas unidas por los puentes de hidrógeno, hablamos de un dímero.
Nótese que uno de estos puentes de hidrógeno es C=O···H-O y el otro O-H···O=C. El ácido acético presenta la particularidad de que en fase vapor existe como este dímero.
Celulosa
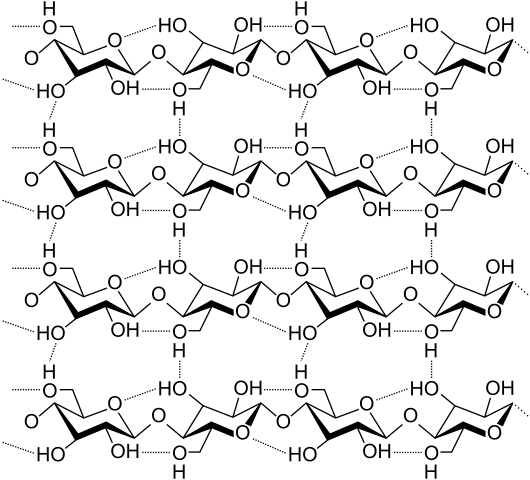
Veamos ahora unos puentes de hidrógeno más diversos y múltiples. La celulosa, un polímero natural, consiste en cadenas compuestas por varias unidades de β-glucosa.
Cada cadena se mantiene fijada a otra gracias a muchos puentes de hidrógeno (imagen superior), los cuales refuerzan la cohesión entre las cadenas.
ADN
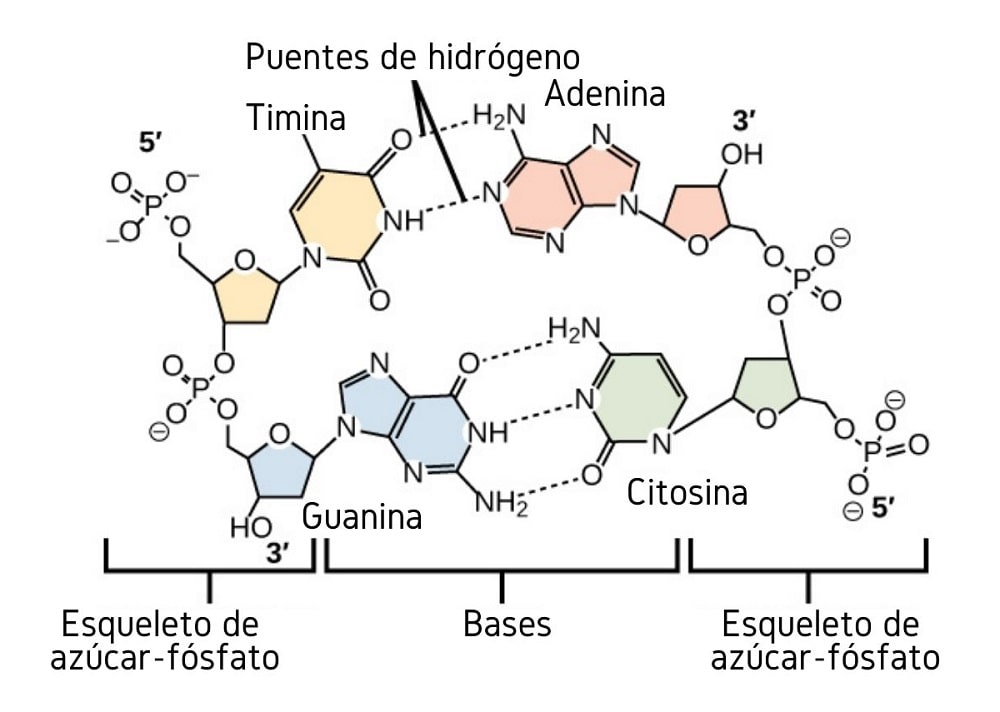
Hasta ahora hemos visto el efecto asociativo que tienen los puentes de hidrógeno para imponer orden entre las moléculas. Pero, ¿qué hay de una macromolécula? En una macromolécula, como la del ADN, encontramos puentes de hidrógeno internos o intramoleculares entre sus bases nitrogenadas timina, adenina, guanina y citosina (arriba).
Los puentes de hidrógeno intramoleculares entre estos pares de bases nitrogenadas, hacen que la molécula de ADN adquiera una estructura de doble hélice, la cual es ideal para su replicación. Si estos puentes de hidrógeno se rompen por calentamiento, la doble hélice se terminará abriendo en dos segmentos o bandas individuales.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Edward E. Ávila & Asiloé J. Mora. (2004). El enlace puente de hidrógeno y sus aplicaciones. Universidad de Los Andes, Facultad de Ciencias, Departamento de Química.
- Wikipedia. (2020). Hydrogen bond. Recuperado de: en.wikipedia.org
- Pietri J. & Clark J. (21 de agosto de 2020). Hydrogen Bonding. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- The Editors of Encyclopaedia Britannica. (2020). Hydrogen bonding. Recuperado de: britannica.com
- Helmenstine, Anne Marie, Ph.D. (29 de octubre de 2020). What Are Examples of Hydrogen Bonding? Recuperado de: thoughtco.com
