Anfóteros: que son, tipos y ejemplos
Los anfóteros son los compuestos o iones que tienen la particularidad de poder comportarse como ácido o como base, de acuerdo con la teoría de Bronsted y Lowry. Su nombre proviene de la palabra griega amphoteroi, la cual significa “ambos”.
Muchos metales forman óxidos o hidróxidos anfóteros, entre ellos el cobre, el zinc, el estaño, el plomo, el aluminio y el berilio. La característica anfótera de estos óxidos depende de los estados de oxidación del óxido en cuestión. Al final del artículo se incluyen ejemplos de estas sustancias.
Los óxidos de metal que pueden reaccionar con ácidos y con bases para producir sales y agua son conocidos como óxidos anfóteros. Los óxidos de plomo y zinc son muy buenos ejemplos, entre otros compuestos.
Índice del artículo
- 1 ¿En qué consisten los anfóteros?
- 2 Tipos de anfóteros
- 3 Ejemplos de sustancias anfóteras
- 4 Diferencias entre anfóteros, anfipróticos, anfolitos y apróticos
- 5 Referencias
De acuerdo con la teoría ácido-base de Bronsted y Lowry, los ácidos son aquellas sustancias que donan protones, mientras que las bases son aquellas que aceptan o toman los protones.
Una molécula llamada anfótera tendrá reacciones en las cuales adquiere protones, como también tendrá la capacidad de donarlos (aunque no siempre es así, como se verá en la siguiente sección).
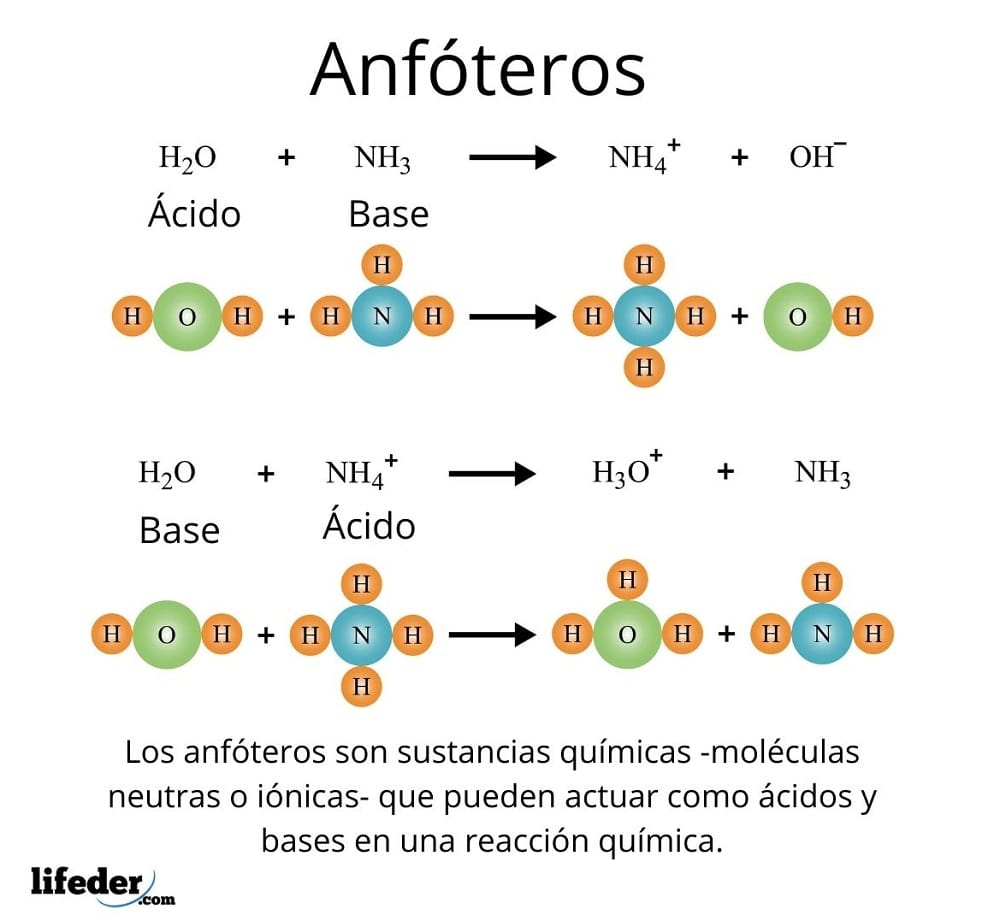
Un caso importante y muy reconocido es el del solvente universal, el agua (H₂O). Esta sustancia reacciona con facilidad con ácidos, por ejemplo, en la reacción con el ácido clorhídrico:
H2O + HCl → H3O+ + Cl–
Pero a su vez, tampoco tiene problemas para reaccionar con una base, como en el caso del amoníaco:
H2O + NH3 → NH4 + OH–
Con estos ejemplos se puede observar que el agua actúa plenamente como una sustancia anfótera.
Aun cuando las sustancias anfóteras pueden ser moléculas o iones, existen unas moléculas que mejor demuestran las características anfóteras y ayudan a estudiar mejor este comportamiento: las sustancias anfipróticas. Estas son moléculas que específicamente pueden donar o aceptar un protón para actuar como ácido o base.
Debe aclararse que todas las sustancias anfipróticas son anfóteras, pero no todas las anfóteras son anfipróticas; existen anfóteros que no poseen protones, pero pueden comportarse como ácidos o bases de otras maneras (como por la teoría de Lewis).
Entre las sustancias anfipróticas se encuentran el agua, los aminoácidos y los iones de bicarbonato y sulfato. A su vez, las sustancias anfipróticas también se subclasifican según su capacidad de donar o ceder protones:
Son aquellas que tienen mayor tendencia a ceder un protón que a aceptar uno. Entre estas se encuentran el ácido sulfúrico (H2SO4) y el ácido acético (CH3COOH), entre otros.
Son aquellas para las que aceptar un protón es más común que cederlo. Entre estas sustancias se puede encontrar el amoníaco (NH3) y la etilendiamida [C2H4(NH2)2].
Tienen igual facilidad o capacidad de aceptar un protón como de cederlo. Entre estos están el agua (H2O) y los alcoholes menores (-ROH), principalmente.
Ahora bien, ya descritas las sustancias anfóteras es necesario denotar los ejemplos de reacciones en las que se presentan estas características.
El ion del ácido carbónico presenta un caso básico de una sustancia anfiprótica; a continuación se representan sus reacciones cuando actúa como ácido:
HCO3– + OH– → CO32- + H2O
La siguiente reacción se da cuando actúa como base:
HCO3– + H3O+ → H2CO3
También existen muchas otras sustancias. De estas se tienen los siguientes ejemplos:
El óxido de zinc, como ya se mencionó, es un anfótero mas no una sustancia anfiprótica. A continuación se demuestra por qué.
Comportándose como ácido:
ZnO + H2SO4 → ZnSO4 + H2O
Comportándose como base:
ZnO + 2NaOH + H2O → Na2[Zn(OH)4]
El óxido de plomo (PbO), aluminio (Al2O3) y estaño (SnO) también tienen sus propias características anfóteras:
Comportándose como ácidos:
PbO + 2HCl → PbCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
SnO + HCl ↔ SnCl + H2O
Y como bases:
PbO + 2NaOH + H2O → Na2[Pb(OH)4]
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
SnO + 4NaOH + H2O ↔ Na4[Sn(OH)6]
También existen óxidos anfóteros a partir del galio, el indio, el escandio, el titanio, el circonio, el vanadio, el cromo, el hierro, el cobalto, el cobre, la plata, el oro, el germanio, el antimonio, el bismuto y el telurio.
Los hidróxidos también pueden presentar características anfóteras, como en los casos del hidróxido de aluminio y el de berilio. A continuación se observan ambos ejemplos:
Hidróxido de aluminio como ácido:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Hidróxido de aluminio como base:
Al(OH)3 + NaOH → Na[Al(OH)4]
Hidróxido de berilio como ácido:
Be(OH)2 + 2HCl → BeCl2 + H2O
Hidróxido de berilio como base:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Es necesario saber diferenciar el concepto de cada término, ya que su parecido se puede volver confuso.
Se sabe que los anfóteros son sustancias que se comportan como ácidos o bases en una reacción que produce una sal y agua. Pueden hacer esto por donación o captación de un protón, o simplemente por aceptar un par electrónico (o cederlo) según la teoría de Lewis.
En cambio, las sustancias anfipróticas son aquellas anfóteras que actúan como ácidos o bases con la donación o captación de un protón, según la ley de Bronsted-Lowry. Todas las sustancias anfipróticas son anfóteras, pero no todas las anfóteras son anfipróticas.
Los compuestos anfolitos son moléculas anfóteras que existen como zwitteriones y poseen iones dipolares en ciertos intérvalos de pH. Se usan como agentes amortiguantes en disoluciones buffer.
Finalmente, los disolventes apróticos son aquellos que no poseen protones para ceder y tampoco puede aceptarlos.
- Amphoteric. (2008). Wikipedia. Obtenido de en.wikipedia.org
- Anne Marie Helmenstine, P. (2017). What Does Amphoteric Mean in Chemistry?. Obtenido de thoughtco.com
- BICPUC. (2016). Amphoteric Compounds. Obtenido de medium.com
- Chemicool. (s.f.). Definition of amphoteric. Obtenido de chemicool.com.
