Ácido sulfúrico (H2SO4): estructura, propiedades, obtención, aplicaciones

¿Qué es el ácido sulfúrico?
El ácido sulfúrico, también llamado sulfato de hidrógeno y aceite de vitriolo, es un ácido oxácido del azufre formado por la reacción del anhídrido sulfúrico (SO3) y agua. Su fórmula molecular es H2SO4 y es, por mucho, el ácido mineral más producido y utilizado en todo el mundo.
Se trata de un ácido mineral fuerte y altamente corrosivo que es miscible con el agua por lo que se puede preparar en forma de soluciones de casi cualquier concentración entre 0 y alrededor de 18 molar.
Los altos volúmenes de producción y consumo de este compuesto se deben a sus múltiples aplicaciones en industrias tan variadas como la agricultura, la industria petroquímica, en la síntesis orgánica e inorgánica y en el tratamiento de aguas residuales, por nombrar solo algunas.
Estructura del ácido sulfúrico
El ácido sulfúrico está formado por un átomo central de azufre con valencia VI el cual está rodeado de 4 átomos de oxígeno, dos de los cuales están enlazados a átomos de hidrógeno. Su estructura de Lewis se presenta a continuación:
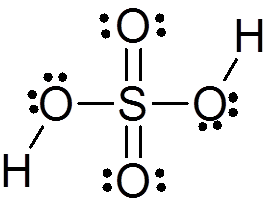
Como se puede ver, el azufre en este compuesto está rodeado de 12 electrones (6 pares), por lo que representa una de las excepciones de la regla del octeto.
Al estar rodeado de 4 átomos, la teoría de la repulsión de los pares de electrones de valencia (TRePEV) predice que este compuesto debe asumir una geometría aproximadamente tetraédrica, la cual se muestra en la siguiente imagen:
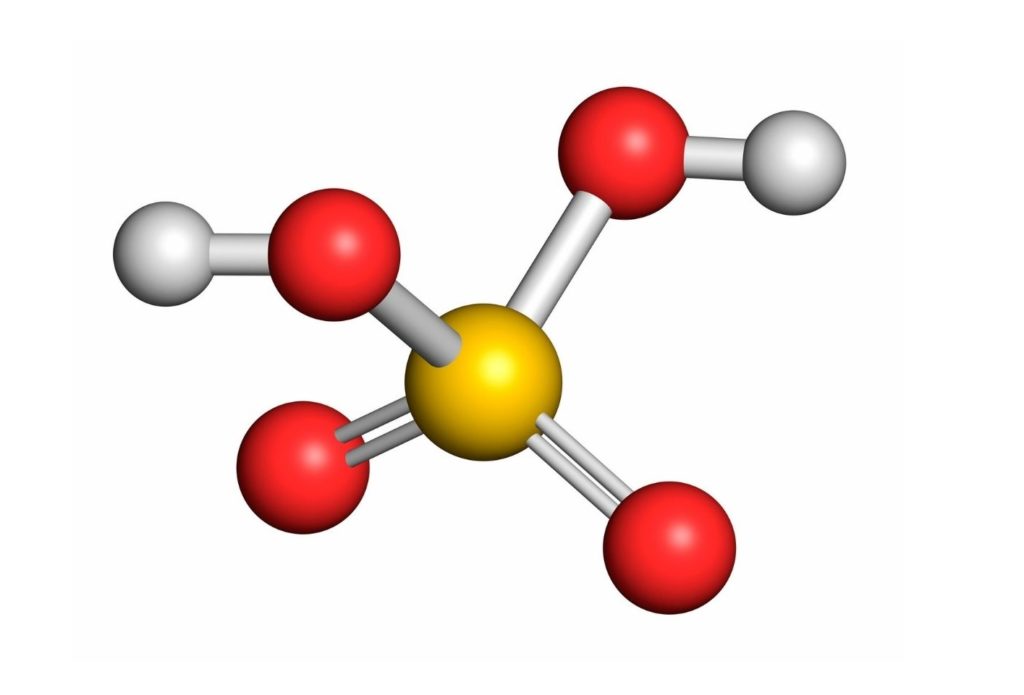
Debido a la alta electronegatividad del oxígeno y a las distintas estructuras de resonancia que puede tener el ácido sulfúrico, los enlaces entre los oxígenos y los hidrógenos están fuertemente polarizados, lo que los convierte en hidrógenos muy ácidos y fáciles de disociar.
Propiedades del ácido sulfúrico
Como consecuencia de su estructura, el ácido sulfúrico posee las siguientes propiedades físicas y químicas:
Propiedades físicas
- El ácido sulfúrico puro es un líquido incoloro e inodoro que posee una densidad de 1,8302 g/mL.
- Su punto de fusión es de 10,31 °C y el de ebullición es de 337 °C, aunque a dicha temperatura tiende a descomponerse para producir agua y anhídrido sulfúrico (también llamado trióxido de azufre).
- Es completamente miscible con el agua, por lo que se pueden preparar soluciones con cualquier concentración. Sin embargo, las soluciones con más de 98,3% en masa de este ácido son inestables y el ácido se descompone hasta que su concentración disminuye a 98,3%. Esta solución es estable y es lo que se conoce como ácido sulfúrico concentrado.
- En su estado puro o concentrado, es un líquido más viscoso que el agua.
Propiedades químicas
- El ácido sulfúrico puro es una sustancia fuertemente oxidante y corrosiva. Tiene la capacidad de oxidar, deshidratar y sulfonar a una gran variedad de compuestos orgánicos y de carbonizar a otros.
- Es un ácido diprótico fuerte que pierde completamente su primer protón al disolverse en agua convirtiéndose así en su base conjugada, el ion bisulfato (HSO4–). Este ion es también un ácido, aunque más débil que el ácido original.
- Las soluciones acuosas de ácido sulfúrico son fuertemente ácidas y son capaces de disolver a muchos metales, generando al mismo tiempo hidrógeno gaseoso. También son capaces de neutralizar completamente a las bases fuertes.
- Reacciona violentamente con muchos alcoholes y con el agua, liberando grandes cantidades de calor en el proceso.
¿Cómo se obtiene el ácido sulfúrico?
Los tres procesos industriales de producción de ácido sulfúrico más conocidos son: el proceso de contacto, el proceso húmedo de ácido sulfúrico y el proceso de las cámaras de plomo.
1. Síntesis de ácido sulfúrico por el proceso de contacto
Este es el método más utilizado en la actualidad para producir ácido sulfúrico. El proceso consiste en 5 pasos en los que el azufre elemental se convierte en dióxido de azufre (SO2), luego trióxido de azufre (SO3), ácido disulfúrico (H2S2O7) y, finalmente, en ácido sulfúrico. Las reacciones involucradas son:

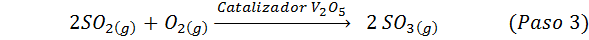


El segundo paso del proceso consiste simplemente en la purificación del dióxido de azufre antes de ser convertido a trióxido de azufre o anhídrido sulfúrico. La reacción del tercer paso ocurre cuando el dióxido de azufre gaseoso entra en contacto con un catalizador sólido de pentaóxido de vanadio (V2O5), y es por esto que el método se llama proceso de contacto.
2. Síntesis de ácido sulfúrico por el proceso húmedo
Este proceso fue diseñado para purificar los gases de emisión de una gran variedad de industrias y plantas químicas. El subproducto de esta purificación es ácido sulfúrico de grado comercial además de vapor de agua caliente, que se puede reutilizar en el proceso industrial original.
En el caso del proceso húmedo, las reacciones se llevan a cabo, en su mayoría, en estado gaseoso y consta de una etapa de combustión, una de oxidación, luego una de hidratación y, finalmente una etapa de condensación del producto final. Las reacciones importantes que ocurren en cada etapa son:
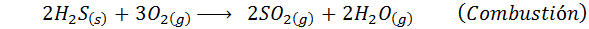
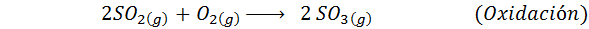
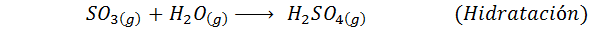
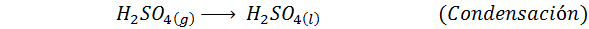
3. Síntesis de ácido sulfúrico por el proceso de las cámaras de plomo
Este es un método antiguo para producir ácido sulfúrico que hoy en día se utiliza muy poco. El proceso consistía en quemar azufre elemental en presencia del oxígeno del aire en unas cámaras de madera recubiertas de plomo, y de allí su nombre.
Tras esta combustión, el dióxido de azufre luego se hacía reaccionar con óxidos de nitrógenos producidos por la descomposición de nitrato de sodio o por otros medios. Al final, tras una serie de reacciones adicionales, se obtenía ácido sulfúrico.
Aplicaciones comunes
- La principal aplicación del ácido sulfúrico es como fuente de azufre en forma de sulfatos en la fabricación de fertilizantes. De hecho, alrededor del 60% del ácido sulfúrico producido en el mundo se destina para este fin.
- En la industria química se utiliza para la síntesis de detergentes, pigmentos, catalizadores para la industria petroquímica y en el procesamiento de minerales para la obtención de distintos metales.
- Finalmente, el ácido sulfúrico es el electrolito utilizado en las baterías de plomo usadas en la mayoría de los automóviles.
Riesgos asociados con el ácido sulfúrico
Debido a sus propiedades químicas, el ácido sulfúrico puede llegar a ser muy peligroso tanto para los seres humanos como para los animales y el medio ambiente en general. Estos son algunos de los riesgos asociados a esta sustancia química:
- Sus características corrosivas y deshidratantes hacen que el ácido puro pueda causar grandes daños si entra en contacto con la piel.
- Por otro lado, la reacción de las soluciones acuosas de ácido sulfúrico con los metales genera hidrógeno gaseoso, el cual es una sustancia combustible y explosiva.
- El ácido sulfúrico en sí no sufre una reacción de combustión, pero, al ser un oxidante fuerte, estimula la combustión de otras sustancias, actuando como una especie de catalizador, por lo que representa un riesgo de incendio considerable.
- Además, al ser expuesto al fuego, se puede descomponer en gases tóxicos y generar vapores de ácido sulfúrico que fácilmente pueden destruir las vías respiratorias.
Por estas razones y más, el ácido sulfúrico es una sustancia que se debe manejar con cuidado.
