Enlace covalente: características, tipos, ejemplos
¿Qué es un enlace covalente?
El enlace covalente es una interacción fuerte que permite que dos o más átomos se unan para formar moléculas. Se trata de uno de los tipos de enlaces químicos en el cual participa un par de electrones que proviene de los orbitales más externos de los átomos que se enlazan.
En teoría, cada átomo aporta uno de los dos electrones al momento de enlazarse covalentemente, de tal modo que ganen estabilidad. El par de electrones, que viene a ser una especie de “gancho electrónico” entre los dos núcleos atómicos, se comparte por igual entre dos átomos idénticos, pero no sucede así cuando los dos átomos son de dos elementos distintos.

Hay átomos o elementos que tienen una tendencia natural de ceder los electrones, mientras que otros prefieren ganarlos.
Por ejemplo, la famosa molécula del agua, H2O, tiene dos enlaces covalentes: H-O-H. Los hidrógenos y el oxígeno comparten los dos pares de electrones, pero estos orbitan más cerca del átomo de oxígeno que de los de hidrógenos. Este fenómeno se debe a la polaridad y electronegatividad.
Características de los enlaces covalentes
Los enlaces covalentes presentan las siguientes características:
-Involucran un par de electrones por cada enlace covalente.
-Sus longitudes usualmente se expresan en unidades de pm (picómetros) o Armstrong (Å).
-Son difíciles de romper, lo que significa que son muy fuertes.
-Cuando se rompen, ocurren cambios o transformaciones químicas, ya que la molécula está perdiendo átomos. En este proceso se absorbe energía.
-Cuando se forman, una nueva molécula nace. En este proceso se libera energía.
-Sus longitudes varían según la avidez que tiene uno de los átomos enlazados hacia el par de electrones; es decir, cuanto más lo atraiga, más se alarga el enlace covalente.
-Los enlaces covalentes más simples solamente existen entre dos átomos a la vez, y se representan con un guión o raya (-).
Hay otras características que aplican para enlaces covalentes más complejos, los cuales sin embargo se ajustan también a lo comentado arriba.
Tipos de enlaces covalentes
Los enlaces covalentes pueden clasificarse, en principio, de dos maneras: según el número de electrones que se comparten, y según la polaridad resultante cuando se forme la molécula. Ambos se describirán superficialmente a continuación.
Según el número de electrones compartidos
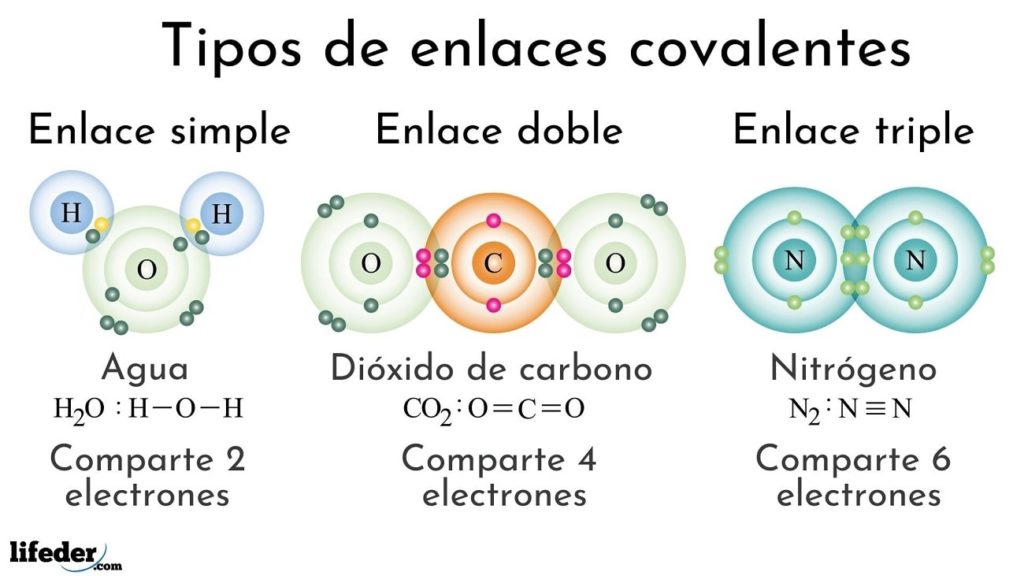
Los enlaces covalentes según el número de electrones compartidos pueden clasificarse en simples, dobles o triples. En la imagen superior se muestran estos respectivos enlaces para tres moléculas que se discutirán abajo.
Simple
El enlace covalente simple es aquel en el que solo hay un par de electrones, es decir, dos electrones. Un ejemplo de este enlace lo vemos en la molécula de agua, H2O. Nótese que de todos los enlaces covalentes, el simple, I-I, es el más largo de todos. Esto es así casi siempre.
Doble
En el enlace covalente doble tenemos, como su nombre indica, dos pares de electrones, lo que significa que hay cuatro electrones que refuerzan el “gancho electrónico” entre los dos átomos enlazados.
Es decir, un enlace doble (=) es más fuerte que uno simple (-). Sin embargo, es más reactivo, lo cual aunque pudiera parecer contradictorio, es fácil de explicar considerando los traslapes de los orbitales atómicos.
Un ejemplo de este enlace lo vemos en la molécula de dióxido de carbono, CO2. Los dos átomos de oxígeno se mantienen fuertemente unidos al carbono gracias a este enlace, O=C=O, el cual, por ser más fuerte, acerca más a los átomos; y a su vez esto conlleva a que se acorte el enlace.
Triple
El enlace triple es el más fuerte y corto de los enlaces covalentes (comunes). Nótese que para la molécula de nitrógeno, N2 o N≡N, sus átomos representados por esferas azuladas se encuentran muy cerca uno del otro.
En el enlace triple tenemos tres pares de electrones, lo cual es igual a seis electrones que refuerzan el enlace covalente entre los dos átomos.
Dativo
El enlace dativo es un tipo especial de enlace simple que consiste en que el par de electrones proviene solo de uno de los dos átomos enlazados. Es decir, pudiera verse como una “compartición forzada”.
Por ejemplo, la molécula H2O utiliza uno de los pares libres de oxígeno para donárselos a un ion H+ (H2O: → H+ = [H2O-H]+ o H3O+).
Según la polaridad
Los enlaces covalentes según la polaridad pueden clasificarse en covalentes polares, o covalentes no polares.
Enlaces covalentes polares
Se da entre dos átomos distintos cuya diferencia de electronegatividad es grande. Esto resulta en la formación de un dipolo, donde un átomo se concentra negativamente (atrae electrones), mientras el otro se concentra positivamente (cede electrones). Por ejemplo, el enlace covalente del HF (H-F) es polar, pues el flúor es más electronegativo que el hidrógeno.
Enlaces covalentes no polares
Se da entre dos átomos idénticos cuya diferencia de electronegatividad es nula o muy pequeña. Las moléculas mencionadas anteriormente: I2, O2 y N2 presentan enlaces covalentes no polares. Por lo tanto, los electrones rondan cerca de ambos átomos con la misma frecuencia.
Ejemplos de enlaces covalentes
Para finalizar se enlistarán otros enlaces covalentes además de los ya explicados, indicándose asimismo sus tipos:
H2S (H-S-H), covalente simple polar | HCl (H-Cl), enlace covalente simple polar |
H2 (H-H), covalente simple no polar | C2H4 (H-C≡C-H), con dos enlaces simples polares (C-H) y un enlace triple no polar (C≡C) |
F2 (F-F), covalente simple no polar | P2 (P≡P), enlace covalente doble no polar (o apolar) |
CO₂ (O=C=O), covalente doble polar | S2 (S=S), enlace covalente doble no polar |
HCN (H-C≡N), con un enlace covalente simple polar (H-C), y otro enlace triple polar (C≡N) | NH3 (N-H), con tres enlaces covalentes simples polares |
Los ejemplos citados corresponden a moléculas pequeñas. Pero los enlaces covalentes están presentes en todas las moléculas existentes, incluyendo los polímeros, biomoléculas, macromoléculas, minerales, cerámicas, hidrocarburos, entre otros muchos.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- María Estela Raffino. (28 de junio de 2020). Enlace Covalente. Concept.de. Recuperado de: concepto.de
- Wikipedia. (2020). Covalent bond. Recuperado de: en.wikipedia.org
- Camy Fung & Nima Mirzaee. (15 de agosto de 2020). Covalent Bonds. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (27 de agosto de 2020). What Is a Covalent Bond in Chemistry? Recuperado de: thoughtco.com
