Modelo atómico de Sommerfeld: características, postulados, ventajas y desventajas
El modelo atómico de Sommerfeld fue creado por el físico alemán Arnold Sommerfeld entre 1915 y 1916, para explicar los hechos que el modelo de Bohr, dado a conocer poco antes en 1913, no podía explicar satisfactoriamente. Sommerfeld presentó sus resultados primero ante la Academia de Ciencias de Baviera y luego los publicó en la revista Annalen der Physik.
El modelo de átomo propuesto por el físico danés Niels Bohr, describe el átomo más simple de todos, el de hidrógeno, pero no podía explicar por qué electrones en un mismo estado energético podían presentar distintos niveles de energía en presencia de campos electromagnéticos.
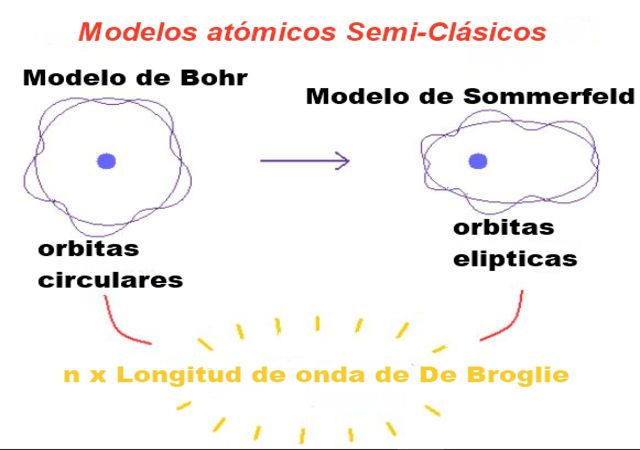
En la teoría propuesta por Bohr, el electrón que orbita alrededor del núcleo solamente puede tener ciertos valores de su momento angular orbital L, y por ende no puede estar en cualquier órbita.
Bohr también consideraba que estas órbitas eran circulares y un solo número cuántico llamado número cuántico principal n = 1, 2, 3… servía para identificar las órbitas permitidas.
La primera modificación introducida por Sommerfeld al modelo de Bohr consistió en suponer que la órbita del electrón también puede ser elíptica.
Una circunferencia se describe mediante su radio, pero para una elipse hay que dar dos parámetros: semieje mayor y semieje menor, además de la orientación espacial de la misma. Con esto introdujo dos números cuánticos más.
La segunda modificación principal que hizo Sommerfeld fue añadir efectos relativistas al modelo atómico. Nada hay más rápido que la luz, sin embargo Sommerfeld había encontrado electrones con velocidades apreciablemente cercanas, por lo tanto era preciso incorporar los efectos relativistas en cualquier descripción del átomo.
Índice del artículo
- 1 Postulados del modelo atómico de Sommerfeld
- 2 Ventajas y desventajas
- 3 Artículos de interés
- 4 Referencias
Los electrones en el átomo siguen órbitas elípticas (las órbitas circulares son un caso particular) y su estado energético se puede caracterizar mediante 3 números cuánticos: el número cuántico principal n, el número cuántico secundario o número azimutal l y el número cuántico magnético mL.
A diferencia de la circunferencia, una elipse tiene un semieje mayor y un semieje menor.
Pero elipses con el mismo semieje mayor, pueden tener distintos semiejes menores, según el grado de excentricidad. Una excentricidad igual a 0 corresponde a una circunferencia, por lo que no descarta las trayectorias circulares. Además, en el espacio las elipses pueden tener distintas inclinaciones.
Por eso Sommerfeld agregó a su modelo el número cuántico secundario l para indicar el semieje menor y el número cuántico magnético mL. Así señalaba cuáles son las orientaciones espaciales permitidas de la órbita elíptica.
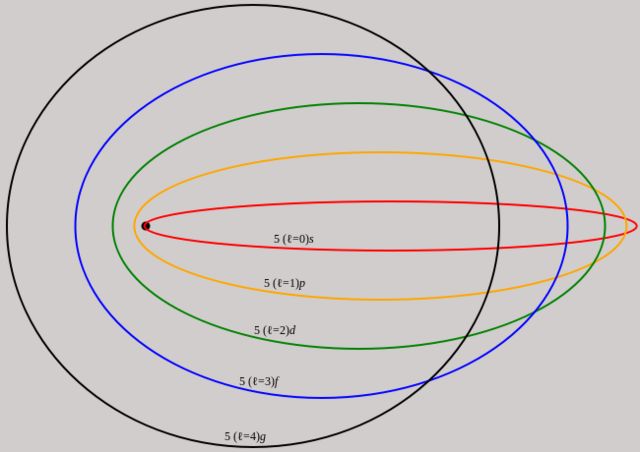
Nótese que no añade nuevos números cuánticos principales, por lo que la energía total del electrón en órbita elíptica es la misma que en el modelo de Bohr. Por lo tanto no hay nuevos niveles de energía, sino un desdoblamiento de los niveles dados por el número n.
Efecto Zeeman y efecto Stark
De esta manera es posible especificar completamente una órbita dada, gracias a los 3 números cuánticos mencionados y así explicar la existencia de dos efectos: el efecto Zeeman y el efecto Stark.
Y así explica el desdoblamiento de la energía que aparece en el efecto Zeeman normal (existe también un efecto Zeeman anómalo), en el cual una línea espectral se divide en varias componentes cuando se encuentra en presencia de un campo magnético.
Este desdoblamiento de las líneas ocurre también en presencia de un campo eléctrico, lo que se conoce como efecto Stark, lo que condujo a Sommerfeld a pensar en la modificación del modelo de Bohr para explicar dichos efectos.
Luego de que Ernest Rutherford descubriera el núcleo atómico y que además se pusiera de manifiesto el hecho de que casi toda la masa del átomo se encuentra concentrada allí, los científicos creían que el núcleo estaba más o menos estacionario.
Sin embargo, Sommerfeld postuló que tanto el núcleo como los electrones en órbita se mueven alrededor del centro de masas del sistema, que por supuesto está muy cercano al núcleo. Su modelo usa la masa reducida del sistema electrón – núcleo, en vez de la masa del electrón.
En órbitas elípticas, al igual que sucede con los planetas alrededor del Sol, hay veces en que el electrón está más cerca, y en otras más lejano al núcleo. Por lo tanto su velocidad es diferente en cada punto de su órbita.

Sommerfeld introdujo en su modelo la constante de estructura fina, una constante sin dimensiones relacionada con la fuerza electromagnética:
α = 1 /137.0359895
Se define como el cociente entre la carga del electrón e elevada al cuadrado, y el producto entre la constante de Planck h y la velocidad de la luz c en el vacío, todo ello multiplicado por 2π:
α = 2π (e2/h.c) = 1 /137.0359895
La constante de estructura fina relaciona a tres de las constantes más importantes de la física atómica. La otra es la masa del electrón, que no figura aquí.
De esta manera se vincula a los electrones con los fotones (que se mueven a velocidad c en el vacío), y así explicar las desviaciones de algunas líneas espectrales del átomo de hidrógeno de las predichas por el modelo de Bohr.
Gracias a las correcciones relativistas, los niveles de energía con igual n pero distinto l se separan, dando lugar a la estructura fina del espectro, de allí el nombre de la constante α.
Y todas las longitudes características del átomo se pueden expresar en términos de esta constante.

-Sommerfeld demostró que un solo número cuántico era insuficiente para explicar las líneas espectrales del átomo de hidrógeno.
-Fue el primer modelo en proponer una cuantización espacial, ya que las proyecciones de las órbitas en la dirección del campo electromagnético están, en efecto, cuantizadas.
-El modelo de Sommerfeld explicó satisfactoriamente que electrones con un mismo número cuántico principal n difieran en su estado energético, ya que pueden tener distintos números cuánticos l y mL.
-Introdujo la constante α para desarrollar la estructura fina del espectro atómico y explicar el efecto Zeeman.
-Incluyó los efectos relativistas, ya que los electrones pueden moverse con velocidades bastante cercanas a la de la luz.
-Su modelo solo era aplicable a los átomos con un electrón y en muchos aspectos a los átomos de los metales alcalinos como el Li2+, pero no es útil en el átomo de helio, que tiene dos electrones.
-No explicaba la distribución electrónica en el átomo.
-El modelo permitió calcular las energías de los estados permitidos y las frecuencias de la radiación emitida o absorbida en las transiciones entre estados, sin dar información acerca de los tiempos de estas transiciones.
-Ahora se sabe que los electrones no siguen trayectorias con formas predeterminadas como órbitas, sino que ocupan orbitales, regiones del espacio que corresponden a soluciones de la ecuación de Schrodinger.
-El modelo combinaba de manera arbitraria aspectos clásicos con aspectos cuánticos.
-No logró explicar el efecto Zeeman anómalo, para esto se necesita el modelo de Dirac, que posteriormente agregó otro número cuántico.
Modelo atómico de Schrödinger.
Modelo atómico de Dirac Jordan.
- Brainkart. Sommerfeld atom model and its drawbacks. Recuperado de: brainkart.com.
- How We Came to Know the Cosmos: Light & Matter. Sommerfeld’s atom. Recuperado de:thestargarden.co.uk
- Parker, P. The Bohr-Sommerfeld Atom. Recuperado de: physnet.org
- Rincón Educativo. Modelo de Sommerfeld. Recuperado de: rinconeducativo.com.
- Wikipedia. Modelo atómico de Sommerfeld. Recuperado de: es.wikipedia,org.
