Nitrato de calcio (Ca(NO3)2): estructura, propiedades y usos
El nitrato de calcio es una sal inorgánica terciaria cuya fórmula química es Ca(NO3)2. A partir de su fórmula se sabe que su sólido se compone en iones Ca2+ y NO3– en una proporción 1:2. Por lo tanto, es un compuesto de naturaleza puramente iónica.
Una de sus propiedades es su carácter oxidante, a raíz del anión nitrato. No es combustible, es decir no arde a altas temperaturas. Al ser no combustible, representa un sólido seguro para manipularlo sin mayores cuidados; sin embargo, puede acelerar la ignición de los materiales combustibles.

Su aspecto consta de sólido granular, que presenta un color blanco o gris claro (imagen superior). Puede ser anhidro o tetrahidratado, Ca(NO3)2·4H2O. Es muy soluble en agua, metanol y acetona.
El nitrato de calcio ha sido usado ampliamente como fertilizante, ya que se desplaza fácilmente en el suelo húmedo, y rápidamente es absorbido por las raíces de las plantas. Suministra dos elementos importantes para la nutrición y crecimiento de las plantas: el nitrógeno y el calcio.
El nitrógeno es uno de los tres elementos esenciales para el desarrollo de las plantas (N, P y K), es imprescindible en la síntesis de proteínas. Mientras, el calcio es necesario para mantener la estructura de la pared celular de las plantas. Por esta razón el Ca(NO3)2 se destina mucho a los jardines.
Por otro lado, esta sal tiene acciones tóxicas, especialmente por contacto directo con la piel y los ojos, así como por inhalación de su polvo. Además, puede descomponerse por calentamiento.
Índice del artículo
- 1 Estructura del nitrato de calcio
- 2 Propiedades físicas y químicas
- 3 Usos
- 4 Formas de aplicación
- 5 Referencias
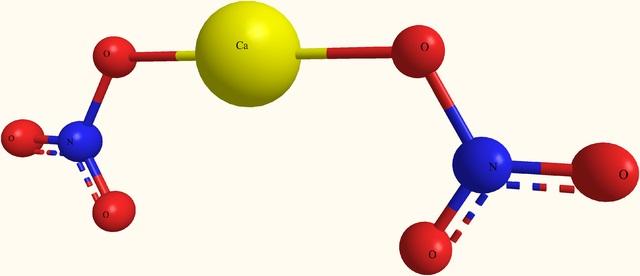
En la imagen superior se muestra la estructura del Ca(NO3)2 en un modelo de esferas y barras. Aquí, sin embargo, hay un defecto: se asume la existencia de enlaces covalentes Ca-O, lo cual contradice su carácter iónico. Aclarando esto, realmente las interacciones son del tipo electrostática.
El catión Ca2+ se rodea de dos aniones NO3– de acuerdo a sus proporciones en el cristal. Predomina por tanto el nitrógeno en forma de nitrato en la estructura cristalina.
Los iones se agrupan de tal manera, que establecen una configuración cuya mínima expresión es la celda unitaria; la cual, para la sal anhidra, es cúbica. Es decir, que a partir de cubos conteniendo la proporción 1:2 para estos iones, se reproduce el cristal por entero.
Por otro lado, la sal tetrahidratada, Ca(NO3)2·4H2O, posee cuatro moléculas de agua por cada conjunto NO3– Ca2+ NO3–. Esto modifica la estructura cristalina, deformándolo en una celda unitaria monoclínica.
Por lo tanto, se espera que los cristales para ambas sales, la anhidra y la tetrahidratada, sean diferentes; diferencias que pueden determinarse en sus propiedades físicas, por ejemplo, los puntos de fusión.
-Nitrato de calcio
-Dinitrato de calcio
-Nitrocalcita
-Salitre noruego y limesaltpetro.
Ca(NO3)2 o CaN2O6
Anhidro 164,088 g/mol y tetrahidratado 236,15 g/mol. Noten el efecto del agua sobre el peso molecular, y no puede despreciarse al momento de hacer su respectiva pesada.
Sólido o gránulos de color blanco o gris claro. Cristales blancos cúbicos o gránulos delicuescentes; esto es, absorben humedad a tal punto que se disuelven producto de su alta solubilidad.
La forma anhidra se descompone por calentamiento a una temperatura que impide la determinación de su punto de ebullición; mientras que la forma tetrahidratada de la sal tiene un punto de ebullición de 132 ºC (270 ºF, 405 K).
-Forma anhidra: 561 ºC a 760 mmHg (1042 ºF, 834 K).
-Forma tetrahidratada: 42,7 ºC (109 ºF, 316 K).
Esto demuestra cómo las moléculas de agua interfieren en las interacciones electrostáticas entre el Ca2+ y NO3– dentro de los cristales; y en consecuencia, el sólido se funde a una temperatura mucho menor.
-Forma anhidra: 1212 g/L a 20 ºC.
-Forma tetrahidratada: 1290 g/L a 20 ºC.
El agua en los cristales apenas aumenta la solubilidad de la sal.
-En el etanol, 51,42 g/100 g a 20 ºC.
-En metanol, 134 g/100 g a 10 ºC.
-En la acetona, 168 g/100 g a 20 ºC.
6,0
2,5 g/cm3 a 25 ºC (tetrahidratado).
Cuando el nitrato de calcio se calienta a incandescencia, se descompone en óxido de calcio, óxido de nitrógeno y oxígeno.
Es un agente fuertemente oxidante, pero no es combustible. Acelera la ignición de los materiales combustibles. La división del nitrato de calcio en partículas finas, facilita su explosión cuando el compuesto se expone al fuego prolongado.
Las mezclas con ésteres de alquilo se convierte en explosiva al originar los ésteres de nitrato de alquilo. La combinación del nitrato de calcio con fósforo, cloruro de estaño (II) u otro agente reductor, puede reaccionar explosivamente.
Se usa en los cultivos como fuente de nitrógeno y calcio. El nitrato de calcio es muy soluble en el agua y fácilmente absorbido por las raíces de las plantas. Además, no acidifica los suelos porque sus iones no pueden hidrolizarse significativamente.
Debe evitarse su mezcla con los fertilizantes que contengan fósforo o sulfato, para evitar la formación de sales insolubles. A raíz de su higroscopicidad, debe almacenarse en un ambiente seco y fresco.
Su uso tiene una ventaja sobre el uso del nitrato de amonio como fertilizante. Si bien este último compuesto aporta nitrógeno a las plantas, interfiere con la absorción del calcio, lo cual podría producir una deficiencia de calcio en las plantas.
El calcio contribuye al mantenimiento de la estructura de la pared celular de las plantas. En presencia de una deficiencia de calcio, los tejidos en formación de las plantas, como las puntas de las raíces, las hojas jóvenes y las puntas de los brotes, a menudo muestran un crecimiento distorsionado.
Disminución del amonio
El nitrato de calcio reduce la acumulación de ácidos grasos volátiles y compuestos fenólicos, fitotóxicos que se acumulan por la descomposición de los residuos de los cultivos de soja.
Además, hay una tendencia del nitrato de calcio a disminuir la concentración de amonio en el suelo, lo que aumenta la capacidad amortiguadora de hidrógeno.
El nitrato de calcio se utiliza para reducir el tiempo de fraguado del concreto. Esto se produce por la generación de hidróxido de calcio, mediante quizás una reacción de doble desplazamiento.
Además, el nitrato de calcio induce la generación del compuesto hidróxido de hierro, cuya acción protectora del concreto reduce su corrosión. Es decir, el hierro presente puede reaccionar con los componentes básicos del concreto, como el propio hidróxido de calcio.
El nitrato de calcio disminuye el tiempo de fraguado, así como la resistencia del concreto, al cual se le agregó cenizas volcánicas. Para estudiar el efecto del agregado de nitrato de calcio al concreto, se han usado concentraciones crecientes del nitrato de calcio, entre un 2% y un 10%.
Se ha observado una disminución mayor del tiempo del fraguado, así como un aumento de la resistencia del concreto a medida que la concentración del nitrato de calcio aumentó hasta un 10%.
El nitrato de calcio se utiliza para reducir los malos olores de las aguas servidas, mediante la disminución de la generación de sulfuro de hidrógeno. Además, se consume la materia orgánica generadora de condiciones anaeróbicas que dificulta la supervivencia de muchas especies biológicas.
El nitrato de calcio tetrahidratado es un compuesto endotérmico, es decir, que tiene la capacidad de absorber calor del medio ambiente que lo rodea. Esto produce un enfriamiento de los cuerpos que entran en contacto con los recipientes que lo contienen.
Las compresas aumentan su temperatura, y para regenerarlas basta con colocarlas en un congelador
El nitrato de calcio se utiliza en la fase de coagulación del látex. Es parte de la solución de inmersión, y cuando entra en contacto con la solución que contiene el látex, rompe su estabilización y provoca su coagulación.
La mezcla binaria de sales de nitratos fundidas, entre ellas la de calcio con otros nitratos, se usa en lugar del aceite térmico en las plantas de energía solar para la transferencia y almacenamiento de calor.
-Se aplica el nitrato de calcio mezclado con el suelo a una concentración de 1,59 kg por 30,48 m2, con un riego adecuado. El nitrato de calcio se solubiliza en el agua, permitiendo su absorción por las raíces de la planta. En los cultivos hidropónicos se disuelve en el agua de cultivo.
-También se usa el nitrato de calcio en forma de spray para rociar las hojas y las flores, siendo un tratamiento eficaz en la prevención de la pudrición de la flor del tomate, de la mancha de corcho y el hoyo amargo de la manzana.
-Se añade a la mezcla formadora del concreto (cemento, arena, piedras y agua) una cantidad de nitrato de calcio, y se determina el efecto que tiene la adición del mismo sobre las propiedades específicas del concreto; tales como velocidad de fraguado y resistencia.
-Se añade nitrato de calcio a una concentración adecuada para reducir los malos olores de las aguas servidas o residuales, a un nivel que los olores sean tolerables para las personas.
- Bonnie L. Grant. (2019). Calcium Nitrate Fertilizer – What Does Calcium Nitrate Do For Plants. Recuperado de: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. y Vyn, T.J. (1990). The use of calcium nitrate to reduce phytotoxin accumulation during corp residue descomposition. Canadian Journal of Soil Science 70(4):723-726.
- Ogunbode, E. B. y Hassan, I.O. (2011). Effect of addition of calcium nitrate on selective properties of concrete containing volcanic ash. Leonardo Electronic Journal of Practices Tecnologies 19:29-38.
- Wikipedia. (2019). Calcium nitrate. Recuperado de: en.wikipedia.org
- Shiqi Dong & col. (2018). Steel corrosion inhibition by calcium nitrate in halide-enriched completion fluid environments. npj Materials Degradation volume 2, Article number: 32.
- Emaginationz Technologies. (2019). Calcium Nitrate Specifications. Recuperado de: direct2farmer.com
- PubChem. (2019). Calcium nitrate. Recuperado de: pubchem.ncbi.nlm.nih.gov
