Cloruro de estaño (II): propiedades, estructura, usos
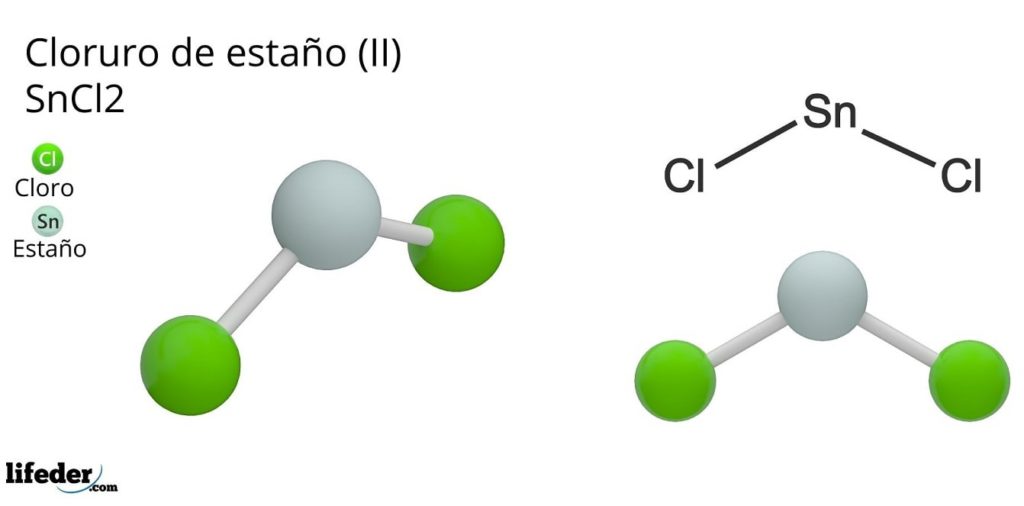
El cloruro de estaño (II) o cloruro estañoso, de fórmula química SnCl2, es un compuesto sólido blanco y cristalino, producto de la reacción del estaño y una solución concentrada de ácido clorhídrico: Sn(s) + 2HCl (conc) => SnCl2(aq) + H2(g). El proceso de su síntesis (preparación) consiste en agregar trozos de estaño limados para que reaccionen con el ácido.
Tras agregar los trozos de estaño se procede a realizar una deshidratación y cristalización hasta obtener la sal inorgánica. En este compuesto, el estaño ha perdido dos electrones de su capa de valencia para formar enlaces con los átomos de cloro.
Esto puede comprenderse mejor si se considera la configuración de valencia del estaño (5s25px2py0pz0), de la cual el par de electrones ocupando el orbital px es cedido a los protones H+, para así formar una molécula diatómica de hidrógeno. Es decir, esta es una reacción de tipo redox.
Índice del artículo
- 1 Propiedades del cloruro de estaño
- 2 Estructura química del cloruro de estaño
- 3 Usos/aplicaciones
- 4 Riesgos
- 5 Referencias

¿Los enlaces del SnCl2 son de tipo iónico o covalente? Las propiedades físicas del cloruro de estaño (II) descartan la primera opción. Los puntos de fusión y ebullición para este compuesto son 247 ºC y 623 ºC, indicativos de interacciones intermoleculares débiles, hecho común para compuestos covalentes.
Sus cristales son de color blanco, lo que se traduce en una absorción nula en el espectro visible.
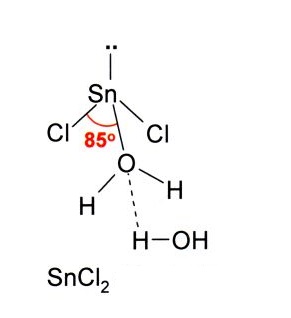
En la imagen de arriba está ilustrada una molécula aislada de SnCl2.
La geometría molecular debería ser plana debido a que la hibridación del átomo central es sp2 (3 orbitales sp2 y un orbital p puro para formar enlaces covalentes), pero el par libre de electrones ocupa volumen y empuja los átomos de cloro hacia abajo, otorgando a la molécula una geometría angular.
En fase gaseosa este compuesto se encuentra aislado, por lo que no interacciona con las demás moléculas.
Como pérdida del par de electrones en el orbital px, el estaño se transforma en el ion Sn2+ y su configuración electrónica resultante es 5s25px0py0pz0, con todos sus orbitales p disponibles para aceptar enlaces de otras especies.
Los iones Cl– se coordinan con el ion Sn2+ para dar origen al cloruro de estaño. La configuración electrónica del estaño en esta sal es 5s25px2py2pz0, siendo capaz de aceptar otro par de electrones en su orbital libre pz.
Por ejemplo, puede aceptar otro ion Cl–, formando el complejo de geometría plano trigonal (una pirámide con base triangular) y cargado negativamente [SnCl3]–.
El SnCl2 tiene reactividad y tendencia altas a comportarse como ácido Lewis (receptor de electrones) para completar su octeto de valencia.
Así como acepta un ion Cl–, lo mismo ocurre con el agua, que “hidrata” el átomo de estaño al enlazarse una molécula de agua directamente al estaño, y una segunda molécula de agua forma interacciones por puentes de hidrógeno con la primera.
El resultado de esto es que el SnCl2 no se encuentra puro, sino coordinado con el agua en su sal dihidratada: SnCl2·2H2O.
El SnCl2 es muy soluble en agua y en solventes polares, debido a que es un compuesto polar. Sin embargo, su solubilidad en agua, menor a su peso en masa, activa una reacción de hidrólisis (ruptura de una molécula de agua) para generar una sal básica e insoluble:
SnCl2(aq) + H2O(l) => Sn(OH)Cl(s) + HCl(aq)
La doble flecha indica que se establece un equilibrio, favorecido hacia la izquierda (hacia los reactivos) si las concentraciones de HCl aumentan. Por esto, las soluciones de SnCl2 empleadas tienen un pH ácido, para evitar la precipitación de la sal indeseada producto de la hidrólisis.
Reacciona con el oxígeno del aire para formar cloruro de estaño (IV) o cloruro estáñico:
6 SnCl2(aq) + O2(g) + 2H2O(l) => 2SnCl4(aq) + 4Sn(OH)Cl(s)
En esta reacción el estaño se oxida formando enlace con el átomo electronegativo de oxígeno y aumenta su número de enlaces con los átomos de cloro.
En general, los átomos electronegativos de los halógenos (F, Cl, Br y I) estabilizan los enlaces de los compuestos de Sn (IV) y este hecho explica por qué el SnCl2 es un agente reductor.
Cuando se oxida y pierde todos sus electrones de valencia, el ion Sn4+ queda con una configuración 5s05px0py0pz0, siendo el par de electrones en el orbital 5s los más difíciles de ser “arrebatados”.
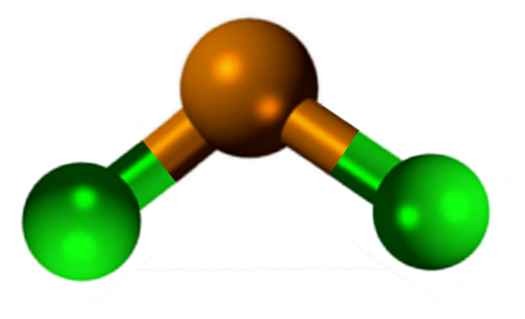
El SnCl2 presenta una estructura cristalina de tipo ortorrómbica, semejante a unas hileras de serruchos, en las cuales las puntas de los dientes son los cloruros.
Cada hilera es una cadena de SnCl3 formando un puente de Cl con otro átomo de Sn (Cl-Sn(Cl)2-Cl-···). Dos cadenas, unidas por interacciones débiles del tipo Sn—Cl constituyen una capa del arreglo, la cual se superpone encima de otra capa, y así sucesivamente hasta definir el sólido cristalino.
El par de electrones libre 5s2 causa distorsión en la estructura debido a que ocupa volumen (el volumen de la nube electrónica).
El Sn puede tener un número de coordinación igual a nueve, lo que es igual a tener nueve vecinos, dibujando un prisma trigonal con este situado en el centro de la figura geométrica y los Cl en los vértices, además de otros Cl ubicados en cada una de las caras cuadradas del prisma.
Esto es más fácil de observar si se considera una cadena en donde los Sn (esferas grises oscuras) apunten hacia arriba, y los tres Cl enlazados con este forman el piso triangular, mientras que los tres Cl superiores forman el techo triangular.
En síntesis orgánicas es empleado como agente reductor de los compuestos nitro aromáticos (Ar-NO2 à Ar-NH2). Como su estructura química es laminar, encuentra uso en el mundo de la catálisis de reacciones orgánicas, además de ser un candidato potencial para soporte catalítico.
Su propiedad reductora es aprovechada para determinar la presencia de compuestos de oro, para revestir vidrios con espejos de plata y para fungir como antioxidante.
También, en su geometría molecular pirámide trigonal (:SnX3– M+) es utilizado como base Lewis para la síntesis de una vasta cantidad de compuestos (como por ejemplo, el complejo clúster Pt3Sn8Cl20, donde el par libre de electrones se coordina con un ácido de Lewis).
El SnCl2 puede dañar las células blancas de la sangre. Es corrosivo, irritante, cancerígeno, y tiene altos impactos negativos en las especies que habitan los ecosistemas marinos.
Puede descomponerse a altas temperaturas, liberando el nocivo gas cloro. En contacto con agentes muy oxidantes desencadena reacciones explosivas.
- Shiver & Atkins. (2008). Química Inorgánica. En Los elementos del grupo 14 (cuarta edición., pág. 329). Mc Graw Hill.
- ChemicalBook. (2017). Recuperado de ChemicalBook: chemicalbook.com
- PubChem. (2018). Tin Chloride. Recuperado de PubChem: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2017). Tin(II) chloride. Recuperado de Wikipedia: en.wikipedia.org
- F. Hulliger. (1976). Structural Chemistry of Layer-Type Phases. P-120,121. D. Reidel Publishing Company.
