Ésteres: qué son, propiedades, estructura,formación, usos, ejemplos

¿Qué son los ésteres?
Los ésteres son compuestos orgánicos que presentan un componente de ácido carboxílico y otro de alcohol. Su fórmula química general es RCO2R’ o RCOOR’. El lado derecho, RCOO, corresponde al grupo carboxilo, mientras que el derecho, OR’ es el alcohol. Los dos comparten un átomo de oxígeno y comparten cierta semejanza con los éteres (ROR’).
Por esta razón el acetato de etilo, CH3COOCH2CH3, el más simple de los ésteres, se consideró como el éter del ácido acético o de vinagre, y de allí el origen etimológico del nombre ‘éster’. De modo que un éster consiste en la sustitución del hidrógeno ácido del grupo COOH, por un grupo alquilo proveniente de un alcohol.
¿Dónde se encuentran los ésteres?
Desde los suelos de la química orgánica, son muchas sus fuentes naturales. El agradable olor de las frutas, como el de las bananas, peras y manzanas, es producto de la interacción de los ésteres con muchos otros componentes. Asimismo se los encuentra en forma de triglicéridos en aceites o grasas.
Nuestro organismo fabrica triglicéridos a partir de los ácidos grasos, los cuales poseen cadenas carbonadas largas, y el alcohol glicerol. Lo que diferencia a unos ésteres de otros reside tanto en R, la cadena del componente ácido, como en R’, la del componente alcohólico.
Un éster de bajo peso molecular debe tener pocos carbonos en R y R’, mientras que otros, como las ceras, tienen muchos carbonos especialmente en R’, el componente alcohólico, y por lo tanto altos pesos moleculares.
Sin embargo, no todos los ésteres son estrictamente orgánicos. Si se sustituye el átomo de carbono del grupo carbonilo por uno de fósforo, entonces se tendrá RPOOR’. Este se conoce como un éster fosfato, y son de crucial importancia en la estructura del ADN.
Así, siempre que un átomo pueda enlazarse eficientemente al carbono o al oxígeno, como el azufre (RSOOR’), puede formar en consecuencia un éster inorgánico.
Propiedades de los ésteres
Los ésteres no son ácidos ni alcoholes, por lo que no se comportan como tales. Sus puntos de fusión y ebullición, por ejemplo, son menores que aquellos con pesos moleculares similares, pero más cercanos en valores a los de los aldehídos y las cetonas.
El ácido butanoico, CH3CH2CH2COOH, tiene un punto de ebullición de 164º C, mientras que el acetato de etilo, CH3COOCH2CH3, de 77.1º C.
Aparte del reciente ejemplo, los puntos de ebullición del 2-metilbutano, CH3CH(CH3)CH2CH3, del acetato de metilo, CH3COOCH3, y del 2-butanol, CH3,CH(OH)CH2CH3, son los siguientes: 28, 57 y 99º C. Los tres compuestos tienen pesos moleculares de 72 y 74 g/mol.
Los ésteres de bajos pesos moleculares tienden a ser volátiles y a tener olores agradables, razón por la que su contenido en las frutas les confiere sus fragancias familiares. Por otro lado, cuando sus pesos moleculares son altos, son sólidos cristalinos incoloros e inodoros, o dependiendo de su estructura, pueden exhibir características grasosas.
Solubilidad en agua
Los ácidos carboxílicos y los alcoholes suelen ser solubles en agua, a menos que posean un alto carácter hidrofóbico en sus estructuras moleculares. Lo mismo ocurre con los ésteres. Cuando R o R’ son cadenas cortas, el éster puede interactuar con las moléculas de agua mediante fuerzas dipolo-dipolo y de fuerzas de London.
Esto se debe a que los ésteres son aceptores de puentes de hidrógeno. ¿Cómo? Por sus dos átomos de oxígeno RCOOR’. Las moléculas de agua pueden formar puentes de hidrógeno con cualquiera de estos oxígenos. Pero cuando las cadenas R o R’ son muy largas, estas repelen el agua de su entorno, imposibilitando su disolución.
Un ejemplo evidente de esto ocurre con los ésteres de triglicéridos. Sus cadenas laterales son largas y hacen que los aceites y las grasas sean insolubles en el agua, a menos que estén en contacto con un solvente menos polar, más afín a dichas cadenas.
Reacción de hidrólisis
Los ésteres también pueden reaccionar con las moléculas de agua en lo que se conoce como reacción de hidrólisis. Sin embargo, requieren de un medio lo suficientemente ácido o básico para promover el mecanismo de dicha reacción:
RCOOR’ + H2O => RCOOH + R’OH
(Medio ácido)
La molécula de agua se adiciona al grupo carbonilo, C=O. La hidrólisis ácida se resume en la sustitución de cada R’ del componente alcohólico por un OH proveniente del agua. Nótese también cómo el éster se “rompe” en sus dos componentes: el ácido carboxílico, RCOOH y el alcohol R’OH.
RCOOR’ + OH– => RCOO–+ R’OH
(Medio básico)
Cuando la hidrólisis se realiza en un medio básico, ocurre una reacción irreversible conocida como saponificación. Esta es muy empleada y es la piedra angular en la elaboración de jabones artesanales o industriales.
El RCOO– es el anión carboxilato, estable, el cual se asocia electrostáticamente con el catión predominante en el medio.
Si la base que se utiliza es NaOH, se forma la sal RCOONa. Cuando el éster es un triglicérido, que por definición tiene tres cadenas laterales R, se forman tres sales de ácidos grasos, RCOONa, y el alcohol glicerol.
Reacción de reducción
Los ésteres son compuestos altamente oxidados. Significa que tiene varios enlaces covalentes con el oxígeno. Al eliminar los enlaces C-O, ocurre una ruptura que termina separando a los componentes ácidos y alcohólicos; y más aún, el ácido se reduce a una forma menos oxidada, a un alcohol:
RCOOR’ => RCH2OH + R’OH
Esta es la reacción de reducción. Se necesita de un agente reductor fuerte, como el hidruro de litio y aluminio, LiAlH4, y de un medio ácido que promueva la migración de electrones. Los alcoholes son las formas más reducidas, es decir, las que tienen menos enlaces covalentes con el oxígeno (tan solo uno: C–OH).
Los dos alcoholes, RCH2OH + R’OH, provienen de las dos cadenas respectivas del éster original RCOOR’. Este es un método de síntesis de alcoholes de valor agregado a partir de sus ésteres.
Por ejemplo, si se quisiera fabricar un alcohol de una fuente de ésteres exótica, esta sería una buena ruta para dicho propósito.
Reacción de transesterificación
Los ésteres pueden transformarse en otros si reaccionan en medios ácidos o básicos con alcoholes:
RCOOR’ + R’’OH => RCOOR’’ + R’OH
Estructura de los ésteres
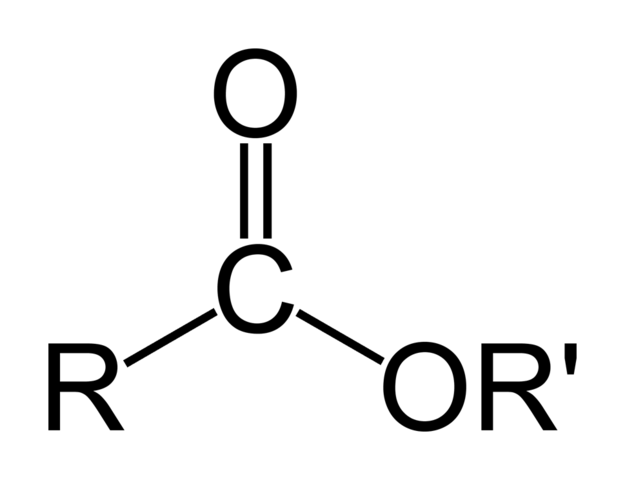
La imagen superior representa la estructura general de todos los ésteres orgánicos. Nótese que R, el grupo carbonilo C=O, y OR’, forman un triángulo plano, producto de la hibridación sp2 del átomo de carbono central. Sin embargo, los demás átomos pueden adoptar otras geometrías, y sus estructuras dependen de la naturaleza intrínseca de R o R’.
Si R o R’ son cadenas alquílicas simples, por ejemplo, del tipo (CH2)nCH3, estas lucirán zigzagueadas en el espacio. Este es el caso del butanoato de pentilo, CH3CH2CH2COOCH2CH2CH2CH2CH3.
Pero en cualquiera de los carbonos de esas cadenas podría encontrarse una ramificación o insaturación (C=C, C≡C), los cuales modificarían la estructura global del éster. Y por esta razón sus propiedades físicas, como la solubilidad y sus puntos de ebullición y fusión, varían con cada compuesto.
Por ejemplo, las grasas insaturadas presentan dobles enlaces en sus cadenas R, los cuales influyen negativamente en las interacciones intermoleculares. Como resultado, descienden sus puntos de fusión, hasta ser líquidas, o aceites, a temperatura ambiente.
Aceptor de puentes de hidrógeno
Aunque en la imagen resalte más el triángulo del esqueleto de los ésteres, son las cadenas R y R’ las responsables de la diversidad en sus estructuras.
Sin embargo, al triángulo sí se le amerita una característica estructural de los ésteres: son aceptores de puentes de hidrógeno. ¿Cómo? Mediante el oxígeno de los grupos carbonilo y alcóxido (el –OR’).
Estos tienen pares de electrones libres, los cuales pueden atraer los átomos de hidrógeno cargados parcialmente positivos de las moléculas de agua.
Por lo tanto, es un tipo especial de interacciones dipolo-dipolo. Las moléculas de agua se acercan al éster (si no lo impiden las cadenas R o R’) y se forman los puentes C=O—H2O, o OH2—O-R’.
Nomenclatura de los ésteres
Para nombrar apropiadamente un éster es necesario tener en cuenta los números de carbonos de las cadenas R y R’. Asimismo, toda posible ramificación, sustituyente o insaturaciones.
Una vez hecho esto, al nombre de la cada R’ del grupo alcóxido –OR’ se le adiciona el sufijo –ilo, mientras que a la cadena R del grupo carboxilo –COOR, el sufijo –ato. Primero se menciona el tramo R, seguido de la palabra ‘de’ y luego el nombre del tramo R’.
Por ejemplo, el CH3CH2CH2COOCH2CH2CH2CH2CH3 tiene cinco carbonos del lado derecho, es decir, son los que corresponden a R’. Y del lado izquierdo hay cuatro átomos de carbonos (incluyendo al del grupo carbonilo C=O).
Por lo tanto, R’ es un grupo pentil, y R un butano (por incluir el carbonilo y considerarse la cadena principal). Entonces, para darle nombre al compuesto, basta con agregar los sufijos correspondientes y nombrarlos en el orden adecuado: butanoato de pentilo.
¿Cómo nombrar al siguiente compuesto:CH3CH2COOC(CH3)3? La cadena -C(CH3)3 corresponde al sustituyente alquílico tert-butil. Como el lado izquierdo posee tres carbonos, es un “propano”. Su nombre entonces es: propanoato de tert-butilo.
¿Cómo se forman los ésteres?
Esterificación
Existen muchas rutas para sintetizar éster, algunas de las cuales pueden ser incluso novedosas. Sin embargo, todas convergen en el hecho de que debe formarse el triángulo de la imagen de la estructura, es decir, el enlace CO-O. Para eso, debe partirse de un compuesto que previamente tenga el grupo carbonilo: como un ácido carboxílico.
¿Y a qué debe enlazarse el ácido carboxílico? A un alcohol, de lo contrario no tendría el componente alcohólico que caracteriza a los ésteres. No obstante, los ácidos carboxílicos requieren de calor y acidez para permitir que el mecanismo de la reacción proceda. La ecuación química siguiente representa lo anterior dicho:
RCOOH + R’OH => RCOOR’ + H2O
(Medio ácido)
Esta se conoce como reacción de esterificación.
Por ejemplo, los ácidos grasos pueden esterificarse con metanol, CH3OH, para sustituir sus H ácidos por grupos metilo, por lo que esta reacción también puede considerarse como de metilación. Este es un paso importante al momento de determinarse el perfil de ácidos grasos de ciertos aceites o grasas.
Ésteres a partir de cloruros de acilo
Otra manera de sintetizar ésteres es a partir de los cloruros de acilo, RCOCl. En ellos, en lugar de sustituir un grupo hidroxilo OH, se sustituye el átomo de Cl:
RCOCl + R’OH => RCOOR’ + HCl
Y a diferencia de la esterificación de un ácido carboxílico, no se libera agua sino ácido clorhídrico.
Dentro del mundo de la química orgánica están disponibles otros métodos, como el de la oxidación de Baeyer-Villiger, el cual usa peroxiácidos (RCOOOH).
Usos de los ésteres
Entre los principales usos de los ésteres se encuentran:
- En la elaboración velas o cirios, como el de la imagen superior. Para este fin se utilizan ésteres de cadenas laterales muy largas.
- Como conservantes de medicinas o alimentos. Esto se debe a la acción de los parabenos, que no son más que ésteres del ácido para-hidroxibenzoico. Aunque conservan la calidad del producto, hay estudios que ponen en duda su efecto positivo sobre el organismo.
- Sirven para la fabricación de fragancias artificiales que imiten el olor y el sabor de muchas frutas o flores. De manera que los ésteres están presentes en golosinas, helados, perfumes, cosméticos, jabones, champús, entre otros productos comerciales que ameriten aromas o sabores atractivos.
- Los ésteres también pueden surtir un efecto farmacológico positivo. Por esta razón la industria farmacéutica se ha dedicado a sintetizar ésteres derivados de ácidos presentes en el organismo para evaluar alguna posible mejoría en el tratamiento de enfermedades. La aspirina es uno de los ejemplos más simples de dichos ésteres.
- Los ésteres líquidos, como el acetato de etilo, son solventes adecuados para determinados tipos de polímeros, como la nitrocelulosa y una gama amplia de resinas.
Ejemplos de ésteres
Algunos ejemplos adicionales de ésteres son los siguientes:
- Butanoato de pentilo, CH3CH2CH2COOCH2CH2CH2CH2CH3, el cual huele a albaricoque y peras.
- El acetato de vinilo, CH3COOCH2=CH2, del cual se produce el polímero acetato de polivinilo.
- Pentanoato de isopentilo, CH3CH2CH2CH2COOCH2CH2CH(CH3)2, el cual imita el sabor de las manzanas.
- Propanoato de etilo, CH3CH2COOCH2CH3.
- Metanoato de propilo, HCOOCH2CH2CH3.
Referencias
- T.W. Graham Solomons, Craigh B. Fryhle. Organic Chemistry. (Tenth Edition, p 797-802, 820) Wiley Plus.
- Carey, F. A. Química Orgánica (2006) Sexta Edición. Editorial Mc Graw Hill-
- Chemistry LibreTexts. Nomenclature of Esters. Recuperado de: chem.libretexts.org
- Admin. (19 de septiembre de 2015). Esters: Its Chemical Nature, Properties and Uses. Tomado de: pure-chemical.com
- Organic Chemistry in our daily life. (09 de marzo de 2014). What are the uses of esters? Recuperado de: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Ejemplos de Ésteres. Recuperado de: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Principales aplicaciones de los Ésteres. Tomado de: uaeh.edu.mx
- Jim Clark. (Enero de 2016). Introducing Esters. Tomado de: chemguide.co.uk
