Óxido de Calcio (CaO): estructura, propiedades, usos
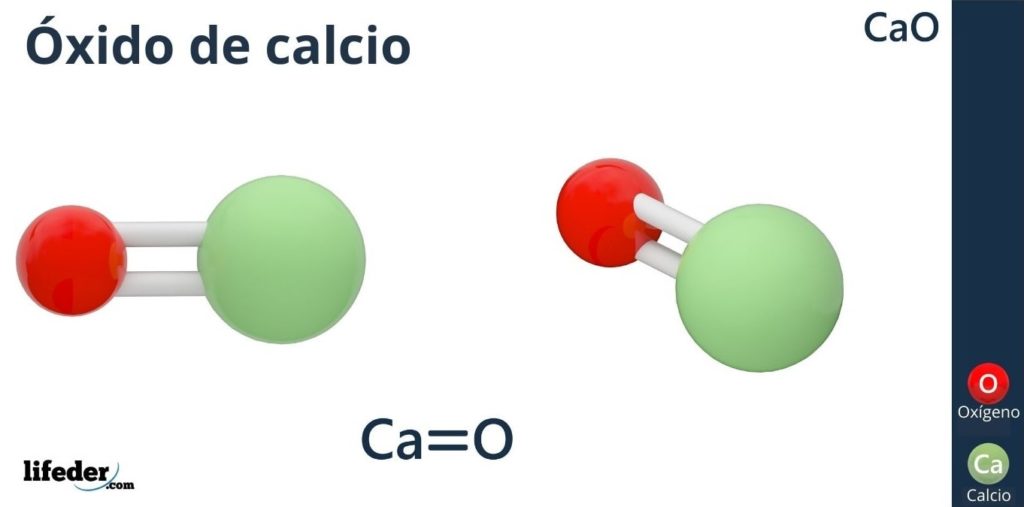
¿Qué es el óxido de calcio?
El óxido de calcio (CaO) es un compuesto inorgánico que contiene calcio y oxígeno en formas iónicas (no confundir con el peróxido de calcio, CaO2). Mundialmente se le conoce como cal, palabra que designa a todo compuesto inorgánico que contiene carbonatos, óxidos e hidróxidos de calcio, además de otros metales tales como silicio, aluminio y hierro.
A este óxido (o cal) también se refieren coloquialmente como cal viva o cal apagada, dependiendo de si está o no hidratado. La cal viva es el óxido de calcio, mientras que la cal apagada es su hidróxido. A su vez, la piedra caliza (piedra de cal o cal endurecida) es en realidad una roca sedimentaria compuesta principalmente de carbonato de calcio (CaCO3).
Es una de las fuentes naturales más grandes de calcio y constituye la materia prima para la producción de óxido de calcio. ¿Cómo se produce este óxido? Los carbonatos son susceptibles a la descomposición térmica; calentando los carbonatos de calcio a temperaturas mayores de 825 ºC, conducen a la formación de cal y dióxido de carbono.
La anterior afirmación puede describirse así: CaCO3(s) → CaO(s) + CO2(g). Debido a que la corteza terrestre es rica en piedra caliza y calcita, y en los océanos y playas son abundantes las conchas marinas (materias primas para la producción de óxido de calcio), el óxido de calcio un reactivo relativamente barato.
Fórmula
La fórmula química del óxido de calcio es CaO, en la cual el calcio está como el ion ácido (aceptor de electrones) Ca2+, y el oxígeno como el ion básico (donador de electrones) O2-.
¿Por qué el calcio tiene carga +2? Porque el calcio pertenece al grupo 2 de la tabla periódica (Sr. Becambara), y solo tiene dos electrones de valencia disponibles para la formación de enlaces, los cuales cede al átomo de oxígeno.
Estructura del óxido de calcio
En la imagen superior está representada la estructura cristalina (tipo sal de gema) para el óxido de calcio. Las esferas rojas voluminosas corresponden a los iones Ca2+ y las esferas blancas a los iones O2-.
En este arreglo cristalino cúbico cada ion Ca2+ está rodeado de seis iones O2-, ocluidos en los huecos octaédricos que dejan los iones grandes entre ellos.
Esta estructura expresa al máximo el carácter iónico de este óxido, aunque la notable diferencia de los radios (la esfera roja es más grande que la blanca) le confiere una energía reticular cristalina más débil si se le compara con el MgO.
Propiedades del óxido de calcio

Físicamente, es un sólido blanco cristalino, inodoro y con fuertes interacciones electrostáticas, las cuales son responsables de sus altos puntos de fusión (2572 ºC) y ebullición (2850 ºC). Además, tiene un peso molecular de 55,958 g/mol y la interesante propiedad de ser termoluminiscente.
Esto quiere decir que un trozo de óxido de calcio expuesto a una llama puede brillar con una intensa luz blanca, conocida en inglés con el nombre limelight, o en español, luz de calcio. Los iones Ca2+, en contacto con el fuego, originan una llama rojiza, tal como se aprecia en la siguiente imagen.
Solubilidad
El CaO es un óxido básico que presenta una fuerte afinidad por el agua, a tal grado que absorbe humedad (es un sólido higroscópico), reaccionando inmediatamente para producir cal apagada o hidróxido de calcio:
CaO(s) + H2O(l) => Ca(OH)2(s)
Esta reacción es exotérmica (desprende calor) debido a la formación de un sólido con interacciones más fuertes y una red cristalina más estable. Sin embargo, la reacción es reversible si se calienta el Ca(OH)2, deshidratándolo y encendiendo la cal apagada; entonces, la cal “renace”.
La solución resultante es muy básica, y si se satura con óxido de calcio alcanza un pH de 12,8.
Igualmente, es soluble en glicerol y en soluciones ácidas y azucaradas. Como es un óxido básico, naturalmente tiene interacciones eficaces con los óxidos ácidos (SiO2, Al2O3 y Fe2O3, por ejemplo) siendo soluble en las fases líquidas de los mismos. Por otro lado, es insoluble en alcoholes y solventes orgánicos.
Usos/aplicaciones
El CaO tiene una vasta infinidad de usos industriales, así como en la síntesis de acetileno (CH≡CH), en la extracción de fosfatos de las aguas residuales y en la reacción con el dióxido de azufre de los desechos gaseosos.
A continuación se describen otros usos del óxido de calcio:
Como mortero
Si el óxido de calcio se mezcla con arena (SiO2) y agua, se apelmaza con la arena y reacciona lentamente con el agua para formar cal apagada. A su vez, el CO2 del aire se disuelve en el agua y reacciona con la sal apagada para formar carbonato de calcio:
Ca(OH)2(s) + CO2(g) => CaCO3(s) + H2O(l)
El CaCO3 es un compuesto más resistente y duro que el CaO, ocasionando que el mortero (la mezcla anterior) se endurezca y fije los ladrillos, bloques o cerámicas entre estos o a la superficie deseada.
En la producción de vidrios
La materia prima esencial para la producción de vidrios son los óxidos de silicio, los cuales son mezclados con la cal, el carbonato de sodio (Na2CO3) y otros aditivos, para luego ser sometidos a calentamiento, resultando en un sólido vidrioso. Este sólido posteriormente es calentado y soplado en cualesquiera figuras.
En la minería
La cal apagada ocupa mayor volumen que la cal viva debido a las interacciones por puentes de hidrógeno (O-H—O). Esta propiedad es aprovechada para romper las rocas desde sus adentros.
Esto se logra rellenándolas con una mezcla compacta de cal y agua, la cual es sellada para enfocar su calor y poder expansivo en el seno de la roca.
Como agente removedor de silicatos
El CaO se funde con los silicatos para formar un líquido coalescente, el cual luego se extrae de la materia prima de un determinado producto.
Por ejemplo, los minerales de hierro son la materia prima para la producción del hierro metálico y el acero. Estos minerales contienen silicatos, los cuales son impurezas indeseables para el proceso y son eliminados mediante el método recién descrito.
Nanopartículas de óxido de calcio
El óxido de calcio puede sintetizarse como nanopartículas, variando las concentraciones de nitrato de calcio (Ca(NO3)2) e hidróxido de sodio (NaOH) en solución.
Estas partículas son esféricas, básicas (así como el sólido a macro escala) y presentan mucha área superficial. En consecuencia, estas propiedades benefician los procesos catalíticos. ¿Cuáles? Las investigaciones actualmente están respondiendo esa pregunta.
Se han utilizado estas nanopartículas para sintetizar compuestos orgánicos sustituidos —como derivados de las piridinas— en la formulación de nuevos fármacos para llevar a cabo transformaciones químicas como la de la fotosíntesis artificial, para la purificación del agua de los metales pesados y nocivos, y como agentes fotocatalíticos.
Las nanopartículas pueden ser sintetizadas sobre un soporte biológico, como las hojas de la papaya y del té verde, para darles así un uso como agente antibacterial.
Referencias
- scifun.org. (2018). Lime: calcium oxide. Recuperado de: scifun.org.
- Wikipedia. (2018). Calcium oxide. Recuperado de: en.wikipedia.org
- PubChem. (2018). Calcium Oxide. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Shiver & Atkins. (2008). Química Inorgánica. En Los elementos del grupo 2. (cuarta edición., pág. 280). Mc Graw Hill.
