Hidróxido de calcio (Ca(OH)2): estructura, propiedades, obtención, usos
El hidróxido de calcio es un compuesto inorgánico cuya fórmula química es Ca(OH)2. Se trata de un polvo blanco que ha venido utilizándose desde hace miles de años, a lo largo de los cuales ha ganado varios nombres o apodos tradicionales; entre ellos, podemos mencionar la cal apagada, muerta, química, hidratada o fina.
En la naturaleza se encuentra disponible en un mineral poco abundante llamado portlandita, del mismo color. Debido a esto el Ca(OH)2 no se obtiene directamente de este mineral, sino de un tratamiento térmico, seguido de una hidratación, de la piedra caliza. De esta se obtiene la cal, CaO, que posteriormente se apaga o hidrata para producir el Ca(OH)2.

El Ca(OH)2 es una base relativamente débil en agua, ya que apenas puede disolverse en agua caliente; pero su solubilidad se incrementa en agua fría, debido a que su hidratación es exotérmica. No obstante, su basicidad continúa siendo motivo para tener cuidado con él durante su manipulación, pues puede ocasionar quemaduras en cualquier parte del cuerpo.
Se ha utilizado como regulador de pH para distintos materiales o alimentos, además de ser una buena fuente de calcio en lo que respecta a su masa. Tiene aplicaciones en la industria del papel, en la desinfección de las aguas servidas, en productos depiladores, en comestibles hechos de harina de maíz.
No obstante, su uso más importante ha sido como material de construcción, pues la cal se hidrata al mezclarse con los otros ingredientes del yeso o mortero. En estas mezclas endurecidas, el Ca(OH)2 absorbe el dióxido de carbono del aire para consolidar los cristales de arena junto con los formados de carbonato de calcio.
Actualmente todavía se llevan a cabo investigaciones con el objetivo de desarrollar mejores materiales de construcción que posean al Ca(OH)2 directamente en su composición como nanopartículas.
Índice del artículo

En la imagen superior tenemos los iones que integran el hidróxido de calcio. Su misma fórmula Ca(OH)2 señala que por cada catión Ca2+ hay dos aniones OH– que interaccionan con él mediante atracción electrostática. El resultado es que ambos iones terminan estableciendo un cristal de estructura hexagonal.
En tales cristales hexagonales de Ca(OH)2 los iones se hallan muy cercanos entre sí, lo cual da la apariencia de ser una estructura polimérica; aunque no exista formalmente un enlace covalente Ca-O dada todavía la notable diferencia de electronegatividad entre los dos elementos.
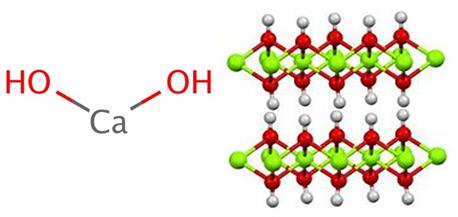
La estructura genera octaedros CaO6, es decir, el Ca2+ interacciona con seis OH– (Ca2+—OH–).
Una serie de estos octaedros componen una capa del cristal, la cual puede interaccionar con otra mediante puentes de hidrógeno que las mantienen intermolecularmente cohesionadas; sin embargo, esta interacción se desvanece a una temperatura de 580 ºC, cuando se deshidrata el Ca(OH)2 a CaO.
Por el lado de las altas presiones, no hay mucha información al respecto, aunque estudios comprobaron que a una presión de 6 GPa el cristal hexagonal sufre una transición de la fase hexagonal a la monoclínica; y con ello, la deformación de los octaedros CaO6 y sus capas.
Los cristales del Ca(OH)2 son hexagonales, pero eso no es impedimento para que puedan adoptar cualquier morfología. Algunas de estas estructuras (tipo hebras, hojuelas o peñones) son más porosas que otras, robustas o planas, lo cual influye directamente en sus aplicaciones finales.
Es así que no es lo mismo utilizar cristales provenientes del mineral portlandita, que sintetizarlos de modo que consten de nanopartículas donde se siga unos cuantos parámetros rigurosos; tales como el grado de hidratación, la concentración del CaO utilizado, y el tiempo que se le permite al cristal crecer.
Sólido polvoriento de color blanco, inodoro, y de sabor amargo.
74,093 g/mol
580 ºC. A esta temperatura se descompone liberando agua, por lo que no alcanza jamás a vaporizarse:
Ca(OH)2 => CaO + H2O
2,211 g/cm3
Una solución acuosa saturada del mismo tiene un pH de 12,4 a 25 ºC.
La solubilidad del Ca(OH)2 en agua decrece con un incremento de la temperatura. Por ejemplo, a 0 ºC su solubilidad es 1,89 g/L; mientras que a 20 ºC y 100 ºC, estas son 1,73 g/L y 0,66 g/L, respectivamente.
Esto indica un hecho termodinámico: la hidratación del Ca(OH)2 es exotérmica, por lo que obedeciendo el principio de Le Chatelier la ecuación vendría a ser:
Ca(OH)2 => Ca2+ + 2OH– + Q
Donde Q es el calor liberado. Mientras más caliente esté el agua, el equilibrio tenderá más a la izquierda; es decir, se disolverá menos el Ca(OH)2. Es por esa razón que en agua fría se disuelve mucho más que en agua hirviendo.
Por otro lado, dicha solubilidad se incrementa si el pH se torna ácido, debido a la neutralización de los iones OH– y al desplazamiento del equilibrio anterior hacia la derecha. Durante este proceso se libera todavía más calor que en el agua neutra. Además de las disoluciones acuosas ácidas, el Ca(OH)2 también es soluble en glicerol.
5,5·10-6. Este valor se considera pequeño y concuerda con la baja solubilidad del Ca(OH)2 en el agua (el mismo equilibrio de arriba).
1,574
El Ca(OH)2 se mantiene estable siempre y cuando no se exponga al CO2 del aire, ya que lo absorbe y se forma carbonato de calcio, CaCO3. Por lo tanto, comienza a impurificarse en una mezcla sólida de cristales Ca(OH)2-CaCO3, donde hay aniones CO32- compitiendo con el OH– para interaccionar con el Ca2+:
Ca(OH)2 + CO2 => CaCO3 + H2O
De hecho, esta es la razón de por qué las soluciones concentradas de Ca(OH)2 se tornan lechosas, pues aparece una suspensión de partículas de CaCO3.
El Ca(OH)2 se obtiene de manera comercial haciendo reaccionar la cal, CaO, con un exceso de dos a tres veces de agua:
CaO + H2O => Ca(OH)2
No obstante, en el proceso puede ocurrir la carbonización del Ca(OH)2, justo como se explicó arriba.
Otros métodos para obtenerlo consiste en utilizar sales solubles de calcio, como el CaCl2 o Ca(NO3)2, y basificarlas con NaOH, para que así precipite el Ca(OH)2. Controlando los parámetros como volúmenes de agua, temperatura, pH, solvente, grado de carbonización, tiempo de maduración, etc., puede sintetizarse nanopartículas con diferentes morfologías.
También puede prepararse seleccionando materia prima natural y renovable, o los desechos de una industria, que sean ricos en calcio, los cuales al calentarse y procesarse sus cenizas consistirán de cal; y a partir de aquí, nuevamente, puede prepararse el Ca(OH)2 mediante la hidratación de estas cenizas sin la necesidad de malgastar piedra caliza, CaCO3.
Por ejemplo, se ha utilizado el bagazo del agave con esta finalidad, asignándole un valor agregado a los desechos de las industrias tequileras.

El hidróxido de calcio se halla presente en muchos alimentos en algunas de sus etapas de preparación. Por ejemplo, en una disolución acuosa del mismo se sumergen encurtidos, como los pepinillos, para tornarlos más crujientes al momento de envasarlos en vinagre. Esto se debe a que las proteínas de su superficie absorben el calcio del medio.
Similarmente ocurre con los granos de maíz antes de transformarlos en harina, pues ayuda a que liberen la vitamina B3 (niacina) y facilita su molienda. El calcio que aporta se aprovecha asimismo para agregarle valor nutricional a ciertos jugos.
El Ca(OH)2 puede además sustituir al polvo de hornear en algunas recetas de panes, y clarificar las soluciones azucaradas obtenidas de la caña de azúcar y las remolachas.
La acción clarificadora del Ca(OH)2 se debe a que actúa como un agente floculante; es decir, aumenta el tamaño de las partículas suspendidas hasta formar flóculos, los cuales sedimentan posteriormente o pueden filtrarse.
Esta propiedad se ha utilizado para desinfectar las aguas servidas, desestabilizando sus coloides desagradables a la vista (y olfato) de los espectadores.
El Ca(OH)2 se utiliza en el proceso Kraft para regenerar el NaOH utilizado para tratar la madera.
El Ca(OH)2 se utiliza para eliminar el CO2 de los espacios cerrados o en ambientes donde su presencia es contraproducente.
En las formulaciones para las cremas depilatorias el Ca(OH)2 se encuentra tácitamente, pues su basicidad ayuda en el debilitamiento de la queratina de los vellos, y así, resulta más fácil removerlos.

El Ca(OH)2 ha estado presente desde tiempos inmemoriales integrando las masas de yeso y mortero utilizadas en la construcción de obras arquitectónicas egipcias como las pirámides; asimismo edificios, mausoleos, murallas, escaleras, pisos, soportes, e inclusive para reconstruir el cemento dental.
Su acción fortificante se debe a que al “respirar” el CO2, los cristales resultantes de CaCO3 terminan de integrar en mejor grado las arenas y los otros componentes de tales mezclas.
El Ca(OH)2 no es un sólido fuertemente básico en comparación a otros hidróxidos, aunque sí más que el Mg(OH)2. Aun así, pese a no ser reactivo ni inflamable, su basicidad todavía sigue siendo lo suficiente agresiva para ocasionar leves quemaduras.
Por lo tanto, debe manipularse con respeto, pues es capaz de irritar los ojos, la lengua y los pulmones, además de desencadenar otros males como: pérdida de visión, severa alcalinización de la sangre, erupciones en la piel, vómito y dolor de garganta.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Calcium hydroxide. Recuperado de: en.wikipedia.org
- Chávez Guerrero et al. (2016). Synthesis and characterization of calcium hydroxide obtained from agave bagasse and investigation of its antibacterial activity. Recuperado de: scielo.org.mx
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Gotou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Crystal structure of the high-pressure phase of calcium hydroxide, portlandite: In situ powder and single-crystal X-ray diffraction study. American Mineralogist; 98 (8-9): 1421–1428. doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (05 de junio de 2019). Calcium Hydroxide. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Aniruddha S. et al. (2015). Synthesis of Nano Calcium Hydroxide in Aqueous Medium. The American Ceramic Society. doi.org/10.1111/jace.14023
- Carly Vandergriendt. (12 de abril de 2018). How Is Calcium Hydroxide Used in Food, and Is It Safe? Recuperado de: healthline.com
- Brian Clegg. (26 de mayo de 2015). Calcium hydroxide. Recuperado de: chemistryworld.com
