Aminas: estructura, propiedades, tipos, usos, ejemplos
Las aminas son compuestos orgánicos derivados del amoníaco. En ellas se producen uniones covalentes entre el carbono y el nitrógeno. Naturalmente, la molécula de nitrógeno es cinéticamente inerte; pero gracias a la fijación biológica, se transforma en amoníaco, el cual a su vez sufre posteriores reacciones de alquilación.
Cuando el amoníaco se “alquila”, sustituye uno, dos o tres de sus tres hidrógenos por átomos de carbonos. Estos carbonos bien pueden provenir de un grupo alquilo (R) o arilo (Ar). Siendo así, existen aminas alifáticas (lineales o ramificadas), y aromáticas.

Arriba se muestra la fórmula general para las aminas alifáticas. Esta fórmula puede utilizarse para las aminas aromáticas, considerando que R puede ser también un grupo arilo Ar. Nótese la semejanza entre la amina y el amoníaco, NH3. Prácticamente, se ha sustituido un H por una cadena lateral R.
Si R consta de cadenas alifáticas, se tiene lo que se conoce como una alquilamina; mientras que si R es de naturaleza aromática, una arilamina. De las arilaminas, la más importante de todas es la alanina: un grupo amino, –NH2, enlazado al anillo bencénico.
Cuando en una estructura molecular hay grupos oxigenados, tales como OH y COOH, el compuesto deja de llamarse una amina. En ese caso, la amina se considera un sustituyente: el grupo amino. Por ejemplo, en los aminoácidos ocurre esto, así como en otras biomoléculas de enorme importancia para la vida.
Por encontrarse al nitrógeno en muchos de los compuestos esenciales para la vida, se consideró aquellos como aminas vitales; es decir, ‘vitaminas’. Sin embargo, muchas de las vitaminas ni siquiera son aminas, y más aún, no todas son vitales para la vida. Empero, esto no niega su gran importancia en los organismos vivos.
Las aminas son bases orgánicas más fuertes que el mismo amoníaco. Son fácilmente extraíbles de la materia vegetal, y generalmente presentan fuertes interacciones con la matriz neuronal de los organismos; de allí que muchos fármacos y drogas consistan de aminas con estructuras y sustituyentes complejos.
Índice del artículo
- 1 Estructura
- 2 Propiedades de las aminas
- 3 Tipos (primarias, secundarias, terciarias)
- 4 Formación
- 5 Nomenclatura
- 6 Usos
- 7 Ejemplos
- 8 Referencias
¿Cuál es su estructura? Si bien varía dependiendo de la naturaleza de R, el entorno electrónico del átomo de nitrógeno es el mismo para todas ellas: tetraédrico. Pero, al haber un par de electrones no compartidos sobre el átomo de nitrógeno (··), la geometría molecular se torna piramidal. Esto es así con el amoníaco y las aminas.
Las aminas pueden representarse con un tetraedro, al igual que como se hace con los compuestos del carbono. Así, NH3 y CH4 se dibujan como tetraedros, donde el par (··) se ubica en uno de los vértices por encima del nitrógeno.
Ambas moléculas son aquirales; sin embargo, comienzan a presentar quiralidad a medida que se sustituyen sus H por R. La amina R2NH es aquiral si los dos R son distintos. Sin embargo, carece de toda configuración para diferenciar un enantiómero de otro (como sí ocurre con los centros quirales de carbono).
Esto se debe a que los enantiómeros:
R2N-H | H-NR2
se intercambian a una velocidad tal que ninguno de los dos puede aislarse; y por lo tanto, las estructuras de las aminas se consideran aquirales aun cuando todos los sustituyentes en el átomo de nitrógeno sean diferentes.
Las aminas son compuestos polares, ya que el grupo amino NH2, por tener un átomo de nitrógeno electronegativo, contribuye al momento dipolar de la molécula. Nótese que el nitrógeno tiene capacidad de donar puentes de hidrógeno, lo que hace que las aminas por lo general tengan puntos de ebullición y fusión altos.
No obstante, al compararse esta propiedad con la de compuestos oxigenados, como los alcoholes y ácidos carboxílicos, resultan de magnitudes menores.
Por ejemplo, el punto de ebullición de la etilamina, CH3CH2NH2 (16,6ºC) es inferior al del etanol, CH3CH2OH (78ºC).
Así, se demuestra que los puentes de hidrógeno O-H son más fuertes que los del N-H, aun cuando una amina pueda formar más de un puente. Esta comparación solo es válida si R tiene el mismo peso molecular para los dos compuestos (CH3CH2–). Por otro lado, el etano hierve a -89ºC, CH3CH3, siendo un gas a temperatura ambiente.
A medida que una amina tiene menos hidrógeno, forma menos puentes de hidrógeno y su punto de ebullición se reduce. Esto se observa si se compara el punto de ebullición de la dimetilamina, (CH3)2NH (7ºC), con el de la etilamina (16,6ºC).
En el mundo de la química, cuando se habla de una amina, surge el acto involuntario de taparse la nariz. Esto se debe a que en general, suelen tener olores desagradables, algunos de los cuales llegan a parecer al del pescado podrido.
Además, las aminas líquidas suelen tener tonalidades amarillentas, que aumentan la desconfianza visual que generan.
Las aminas tienden a ser insolubles en agua debido a que, a pesar de poder formar puentes de hidrógeno con el H2O, su componente orgánico mayoritario es hidrofóbico. Mientras más voluminoso o largo sean los grupos R, menor será su solubilidad en agua.
Cuando hay un ácido en el medio, sin embargo, la solubilidad se incrementa por la formación de lo que se conoce como sales de amina. En ellas, el nitrógeno tiene una carga parcial positiva, la cual atrae electrostáticamente al anión o base conjugada del ácido.
Por ejemplo, en una solución diluida de HCl, la amina RNH2 reacciona de la siguiente manera:
RNH2 + HCl => RNH3+Cl– (sal primaria de amina)
RNH2 era insoluble (o poco soluble) en el agua, y en presencia del ácido forma una sal, cuya solvatación de sus iones favorece su solubilidad.
¿Por qué sucede esto? La respuesta se encuentra en una de las principales propiedades de las aminas: son polares y básicas. Al ser básicas, reaccionaran con ácidos lo suficiente fuertes para protonarlas, de acuerdo a la definición de Brönsted-Lowry.
Las aminas son bases orgánicas más fuertes que el amoníaco. Cuanto mayor sea la densidad electrónica entorno al átomo de nitrógeno, más básica será; es decir, desprotonará más rápidamente los ácidos del medio. Si la amina es muy básica, puede incluso arrebatarle el protón a los alcoholes.
Los grupos R aportan densidad electrónica al nitrógeno por efecto inductivo; ya que, no hay que olvidar que se trata de uno de los átomos más electronegativo existente. Si estos grupos son muy largos o voluminosos, el efecto inductivo será mayor, lo que incrementará asimismo la región negativa alrededor del par de electrones (··).
Esto ocasiona que (··) acepte más rápidamente el ion H+. Sin embargo, si R son muy voluminosos, la basicidad disminuye por efecto estérico. ¿Por qué? Por la sencilla razón de que el H+ deberá franquear una configuración de átomos antes de llegar hasta el nitrógeno.
Otra manera de razonar acerca de la basicidad de una amina es mediante la estabilización de su sal de amina. Ahora, aquella que disminuya por efecto inductivo pueda disminuir la carga positiva N+, será una amina más básica. Las razones son las mismas recién explicadas.
Alquilaminas vs arilaminas
Las alquilaminas son mucho más básicas que las arilaminas. ¿Por qué? Para entenderlo de manera simple, se muestra la estructura de la anilina:
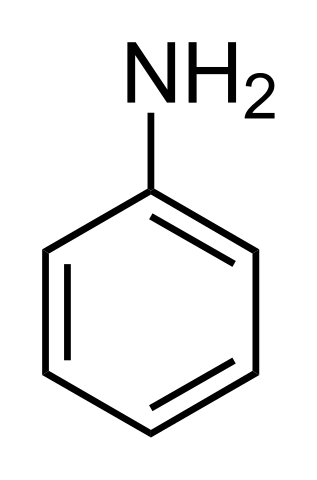
Arriba, en el grupo amino, está el par de electrones (··). Este par “viaja” dentro del anillo en las posiciones orto y para respecto al NH2. Quiere decir, que los dos vértices superiores y el opuesto al NH2 se cargan negativamente, mientras el átomo de nitrógeno, positivamente.
Al estar el nitrógeno cargado positivamente, +N, repelerá al ion H+. Y si esto no fuera suficiente, el par de electrones se deslocaliza dentro del anillo aromático, por lo que está menos accesible para desprotonar los ácidos.
La basicidad de la anilina puede aumentar si se enlazan al anillo grupos o átomos que le donen densidad electrónica, compitiendo con el par (··) y obligándolo a ubicarse con mayor probabilidad en el átomo de nitrógeno, listo para actuar como una base.
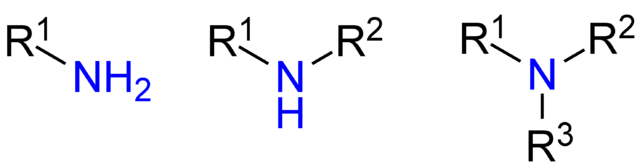
Aunque no se han presentado formalmente, implícitamente se ha hecho referencia a las aminas primarias, secundarias y terciarias (imagen superior, de izquierda a derecha).
Las aminas primarias (RNH2) son las monosustituidas; las secundarias (R2NH), son disustituidas, con dos grupos R alquilo o arilo; y las terciarias (R3N), son trisustituidas, y carece de hidrógeno.
Todas las aminas existentes se derivan de estos tres tipos, por lo que su diversidad e interacciones con la matriz biológica y neuronal son enormes.
En general, podría esperarse que las aminas terciarias fueran las más básicas; sin embargo, no se puede hacer tal afirmación sin conocer las estructuras de R.
Al principio se mencionó que las aminas derivan del amoníaco; por lo tanto, la forma más simple de formarlas es mediante su alquilación. Para ello, se hace reaccionar un exceso de amoníaco con un haluro de alquilo, seguido de la adición de una base para neutralizar la sal de amina:
NH3 + RX => RNH3+X– => RNH2
Nótese que estos pasos conducen a una amina primaria. Pueden formarse también aminas secundarias y hasta terciarias, por lo que el rendimiento para un único producto disminuye.
Algunos métodos de formación, como el de la síntesis de Gabriel, permiten obtener aminas primarias de manera que no se formen otros productos indeseables.
Asimismo, las cetonas y aldehídos pueden reducirse en presencia de amoníaco y aminas primarias, para dar origen a aminas secundarias y terciarias.
Los compuestos nitro pueden reducirse en presencia de hidrógeno y un catalizador para transformarse en sus aminas correspondientes.
ArNO2 => ArNH2
Los nitrilos, RC≡N, y las amidas, RCONR2, se reducen también para dar aminas primarias y terciarias, respectivamente.
¿Cómo se nombran las aminas? La mayoría de las veces se les nombra en función de R, el grupo aquilo o arilo. Al nombre de R, derivado de su alcano, se le añade la palabra ‘amina’ al final.
Así, CH3CH2CH2NH2 es propilamina. Por otro lado, se le puede nombrar considerando solo al alcano y no como un grupo R: propanamina.
La primera forma de nombrarlos es por mucho la más conocida y utilizada.
Cuando hay dos grupos NH2, se nombra el alcano y se enumera las posiciones de los grupos amino. Así, el H2NCH2CH2CH2CH2NH2 se llama: 1,4-butanodiamina.
Si hay grupos oxigenados, como el OH, debe dársele prioridad sobre el NH2, el cual pasa a ser nombrado como un sustituyente. Por ejemplo, HOCH2CH2CH2NH2 se llama: 3-Aminopropanol.
Y respecto a las aminas secundarias y terciarias, se hace uso de las letras N para indicar los grupos R. La cadena más larga se quedará con el nombre del compuesto. Así, el CH3NHCH2CH3 se llama: N-Metiletilamina.
Las aminas aromáticas primarias pueden servir como material de partida para las síntesis de colorantes azo. Inicialmente, las aminas reaccionan para formar sales de diazonio, las cuales forman los compuestos azo mediante copulación azoica (o acoplamiento diazoico).
Estos debido a lo intenso de su coloración, son usados en la industria textil como material de teñido; por ejemplo: anaranjado de metilo, marrón 138 directo, amarillo atardecer FCF y ponceau.
Muchos medicamentos actúan con agonistas y antagonistas de los neurotransmisores amínicos naturales. Ejemplos:
-La clorofeniramina es un antihistamínico usado en el control de los procesos alérgicos debido a la ingesta de algunos alimentos, la fiebre del heno, la picadura de insectos, etc.
-La clorpromazina es un agente sedante, no inductor del sueño. Alivia la ansiedad e inclusive se usa en el tratamiento de algunos trastornos mentales.
-La efedrina y la fenilefedrina se utilizan como descongestionantes de las vías respiratorias.
-La amitriptalina y la imipramina son aminas terciarias que se utilizan en el tratamiento de la depresión. Por su estructura se clasifican cono antidepresivos tricíclicos.
-Los analgésicos opiáceos como la morfina, la codelina y la heroína son aminas terciarias.
Varias aminas, entre ellas la diglicolamina (DGA) y la dietanolamina (DEA), son empleadas en la eliminación de los gases dióxido de carbono (CO2) y el sulfuro de hidrógeno (H2S) presentes en el gas natural y en las refinerías.
Las metilaminas son compuestos intermediarios en la síntesis de productos químicos que se utilizan en la agricultura como herbicidas, fungicidas, insecticidas, y biocidas.
Las metilaminas se emplean durante la elaboración de resinas de intercambio iónico, utilizables en la desionización del agua.
La trimetilamina (TMA) es usada primordialmente en la producción de cloruro de colina, un suplemento de la vitamina B usado en la alimentación de pollos, pavos y cerdos.
El oleato de dimetilamina (DMA) es un emulsionante para uso en la producción de caucho sintético. DMA se usa directamente como un modificador de la polimerización en la fase de vapor del butadieno, y como estabilizador del látex del caucho natural en lugar del amoníaco
La dimetilamina (DMA) y la monometilamina (MMA) se usan para sintetizar los disolventes polares apróticos dimetilformamida (DMF), dimetilacetamida (DMAc) y n-metilpirrolidona (NMP).
Entre las aplicaciones del DMF, se incluyen: recubrimiento de uretano, disolvente de hilados de acrílicos, solventes de reacción y solventes de extracción.
DMAc se utiliza en la fabricación de colorantes y disolvente de hilados. Por último, NMP se emplea en la refinación de aceites lubricantes, decapante de pinturas y recubrimiento de esmaltes.
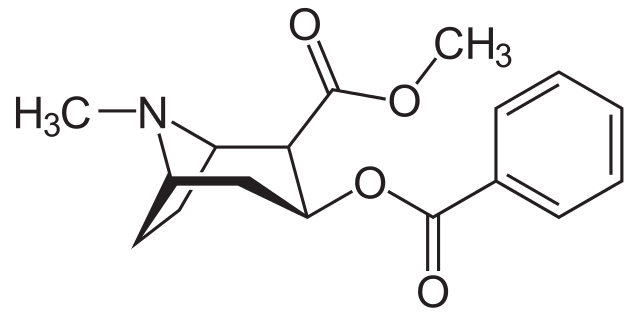
La cocaína es usada como anestésico local en ciertos tipos de cirugía de los ojos, oídos y garganta. Como se ve, es una amina terciaria.
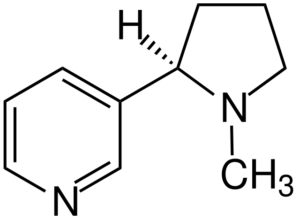
La nicotina es el agente primario de la adicción al tabaco y químicamente es una amina terciaria. La nicotina presente en el humo del tabaco se absorbe rápidamente y es altamente tóxica.
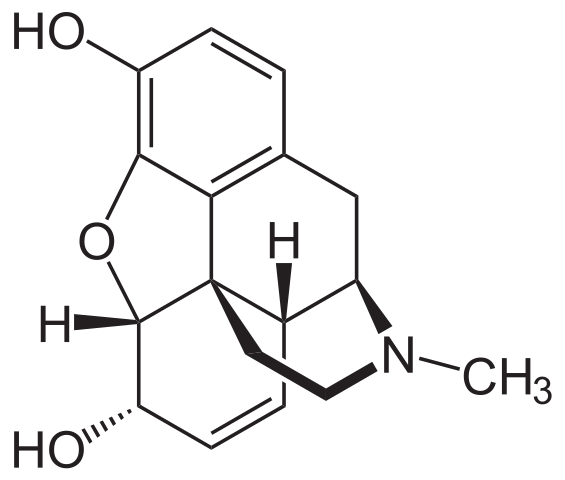
Es uno de los analgésicos más eficaces para aliviar el dolor, especialmente del cáncer. Es, nuevamente, una amina terciaria.
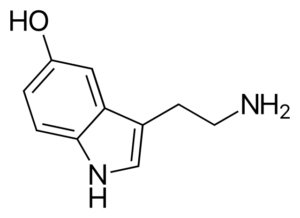
La serotonina es un neurotransmisor amínico. En los pacientes deprimidos la concentración del metabolito principal de la serotonina está disminuido. A diferencia de las otras aminas, esta es primaria.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- The Chemours Company. (2018). Methylamines: uses and applications. Recuperado de: chemours.com
- Transparency Market Research. (s.f.). Amines: important facts and uses. Recuperado de: transparencymarketresearch.com
- Wikipedia. (2019). Amine. Recuperado de: en.wikipedia.org
- Ganong, W. F. (2003). Fisiología Médica. Edición 19ª. Editorial El Manual Moderno.
