Halogenuros de alquilo: propiedades, obtención, ejemplos
Los halogenuros de alquilo son compuestos orgánicos en los cuales un átomo de carbono con hibridación sp3 se enlaza covalentemente a un halógeno (F, Cl, Br, I). Desde otra perspectiva conviene, para simplificar, asumir que se tratan de haloalcanos; estos son, alcanos a los que se les han sustituido unos átomos de H por átomos de halógenos.
Asimismo, tal como su nombre indica, los átomos de halógeno deben estar enlazados a grupos alquílicos, R, para considerársele de este tipo de halogenuro; aunque, estructuralmente pueden estar sustituidos o ramificados y tener anillos aromáticos, y aun así continuar siendo un halogenuro de alquilo.
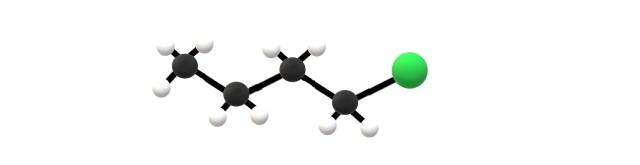
Arriba se tiene la molécula de 1-clorobutano, la cual corresponde a uno de los halogenuros de alquilo más simples. Puede verse que todos sus carbonos poseen enlaces simples, y tienen además hibridación sp3. Por tanto, la esfera verde, correspondiente al átomo de Cl, está enlazada a un esqueleto derivado del alcano butano.
Ejemplos aún más simples que el 1-clorobutano son aquellos derivados del gas metano: el hidrocarburo más pequeño de todos.
A partir de su molécula de CH4 se puede ir sustituyendo átomos de H por, a decir, yodo. Si se sustituye un H, se tendrá el CH3I (yodometano o yoduro de metilo). Al sustituirse dos H, se tendrá el CH2I2 (diyodometano o yoduro de metileno). Seguida y finalmente, los I sustituyen a todos los H dando CHI3 (yodoformo), y CI4 (tetrayoduro de carbono).
Los halogenuros de alquilo se caracterizan por ser muy reactivos y, al poseer los átomos más electronegativos de la tabla periódica, se intuye que a través de sinfines de mecanismos ejerzan una influencia en las matrices biológicas.
Índice del artículo
- 1 Propiedades de los halogenuros de alquilo
- 2 Nomenclatura
- 3 Obtención
- 4 Reacciones
- 5 Ejemplos
- 6 Usos
- 7 Referencias
Las propiedades de esta familia de compuestos dependen de sus estructuras moleculares. Sin embargo, cuando se comparan con las de sus alcanos procedentes, puede observarse notables diferencias causadas por el simple hecho de haber enlaces C-X (X= átomo de halógeno).
Es decir, los enlaces C-X son los responsables de toda diferencia o semejanza entre uno o más halogenuros de alquilo.
Para empezar, los enlaces C-H son casi apolares, dada la poca diferencia de electronegatividad entre el C y el H; en cambio, los enlaces C-X presentan un momento dipolar permanente, debido a que los halógenos son más electronegativos que el carbono (en especial el flúor).
Por otro lado, algunos halógenos son livianos (F y Cl), mientras que otros son pesados (Br y I). Sus masas atómicas también moldean diferencias dentro de los enlaces C-X; y a su vez, directamente en las propiedades del halogenuro.
Por lo tanto, adicionar halógenos a un hidrocarburo es igual a incrementar su polaridad y masa molecular; es igual a volverlo menos volátil (hasta cierto punto), menos inflamable, y aumentar sus puntos de ebullición o fusión.
Dicho lo anterior se muestra, en orden creciente, el tamaño y por ende el peso de los diferentes halógenos:
F Cl Br I
Entonces, cabe esperarse que los halogenuros de alquilo que contengan átomos de F sean más livianos que los que tengan átomos de Br o I.
Por ejemplo, se consideran algunos halogenuros derivados del metano:
CH3F CH3Cl CH3Br CH3I
CH2F2 CH2Cl2 CH2Br2 CH2I2
Y así sucesivamente para los otros derivados producto de un grado de halogenación mayor. Nótese que el orden se mantiene: los halogenuros de flúor son más livianos que los del yodo. No solamente eso, sino que además sus puntos de ebullición y fusión también obedecen este orden; los RF hierven a menores temperaturas que los RI (R= CH3, para este caso).
Asimismo, todos aquellos líquidos son incoloros, ya que en sus enlaces C-X los electrones no pueden absorber ni liberar fotones para transitar otros niveles de energía. No obstante, a medida que se vuelven más pesados pueden llegar a cristalizar y exhibir colores (como lo hace el yodoformo, CHI3).
Los enlaces C-X difieren de polaridad, pero en el orden inverso al de arriba:
C-F > C-Cl > C-Br > C-I
Por lo tanto, los enlaces C-F son más polares que los enlaces C-I. Al ser más polares, los halogenuros RF tienden a interactuar mediante fuerzas dipolo-dipolo. Mientras, en los halogenuros RBr o RI, sus momentos dipolares son más débiles y cobran mayor fuerza las interacciones regidas por las fuerzas de dispersión de London.
Como los halogenuros de alquilo son más polares que los alcanos de los cuales derivan, incrementan su capacidad de disolver un mayor número de compuestos orgánicos. Es por esta razón que tienden a ser mejores disolventes; aunque, no significa que puedan suplantar a los alcanos en todas las aplicaciones.
Hay criterios técnicos, económicos, ecológicos y de rendimiento para preferir un solvente halogenado por encima de un alcano.
Existen dos maneras de nombrar a un halogenuro de alquilo: por su nombre común, o por su nombre sistemático (IUPAC). Los nombres comunes suelen ser más cómodos de utilizar cuando RX es simple:
CHCl3
Cloroformo: nombre común
Tricloruro de metilo o triclorometano: nombre IUPAC.
Pero los nombres sistemáticos son preferibles (y la única opción), cuando se tienen estructuras ramificadas. Irónicamente, los nombres comunes vuelven a ser útiles cuando las estructuras son demasiado complicadas (como las que se verán en el último apartado).
Las reglas para nombrar un compuesto de acuerdo al sistema IUPAC son las mismas que para los alcoholes: se identifica la cadena principal, la cual es la más larga o la más ramificada. Luego, se enumeran los carbonos empezando por el extremo más cercano a los sustituyentes o ramificaciones, nombrándose en orden alfabético.
Para ilustrarlo se tiene el siguiente ejemplo:
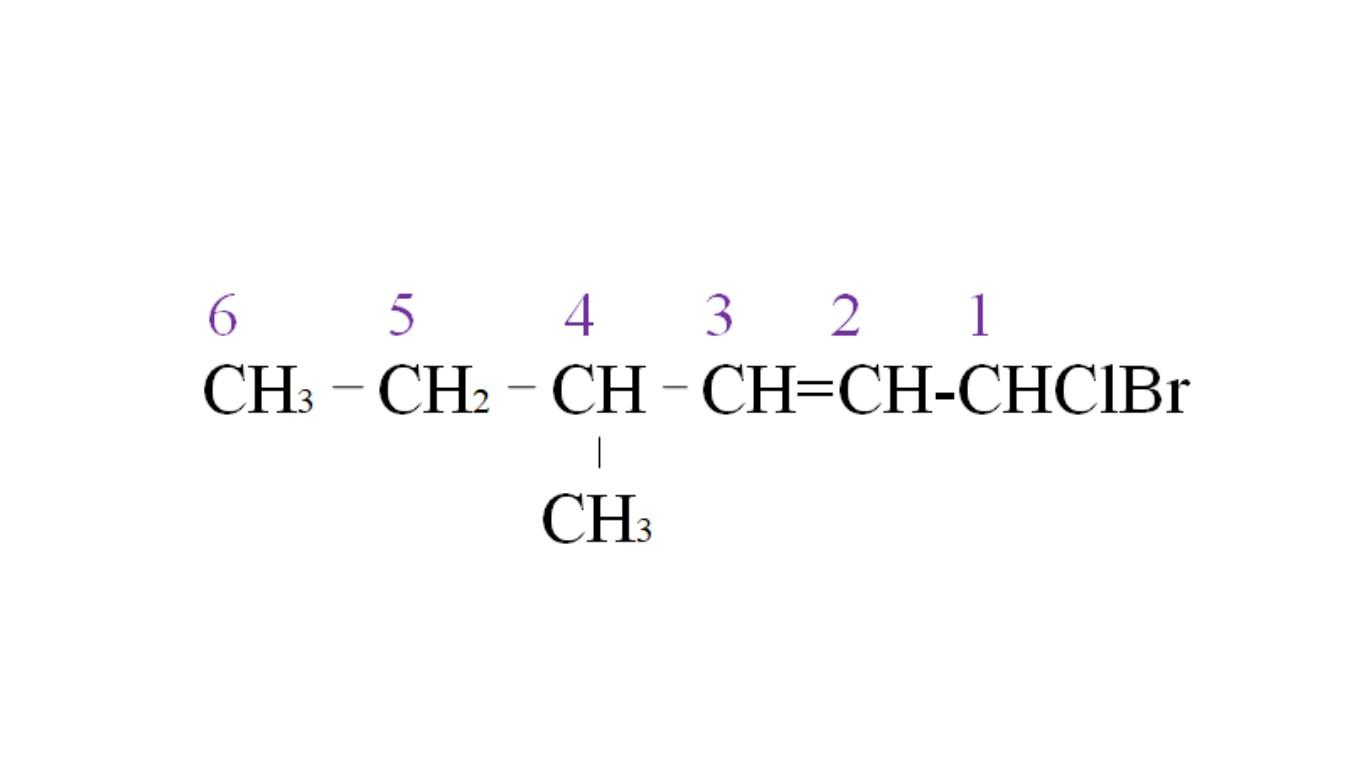
La primera ramificación es el grupo metilo en el C-4; pero, al haber un doble enlace este gana mayor prioridad sobre la regla enunciada. Por esa razón se empieza a enumerar la cadena más larga a partir de la derecha, encabezada por un átomo de carbono enlazado a dos halógenos: Cl y Br.
Con la enumeración, se nombre en orden alfabético los sustituyentes:
1-bromo-1-cloro-4-metil-2-hexeno.
Para obtener los halogenuros de alquilo debe someterse a las moléculas a un proceso de halogenación; es decir, incorporarles átomos de halógenos a sus estructuras, en especial a un átomo a un de carbono sp3.
Hay dos métodos para obtenerlos o sintetizarlos: mediante radiación ultravioleta a través de un mecanismo por radicales libres, o mediante adición de hidrácidos o halógenos.
El primero, el menos apropiado y con el peor de los rendimientos, consiste en irradiar los alcanos con radiación ultravioleta (hv) en presencia de un halógeno. Por ejemplo, se muestran las ecuaciones para la cloración del metano:
CH4 + Cl2 => CH3Cl + HCl (bajo luz ultravioleta)
CH3Cl + Cl2 => CH2Cl2 + HCl
CH2Cl2 + Cl2 => CHCl3 + HCl
CHCl3 + Cl2 => CCl4 + HCl
Los cuatro compuestos (CH3Cl, CH2Cl2, CHCl3 y CCl4) se forman, y por tanto se tiene una mezcla, la cual puede someterse a destilación fraccionada. No obstante, este método resulta poco práctico, y se prefiere recurrir a las síntesis orgánicas.
Otro ejemplo es el de la bromación del n-hexano:
CH3CH2CH2CH2CH2CH3 + Br2 => CH3(Br)CHCH2CH2CH2CH3 + HBr
Nuevamente, en esta reacción se emplea la luz o radiación ultravioleta para favorecer la formación de los radicales libres. El bromo, como es un líquido de color rojo intenso, se decolora a medida que reacciona, observándose así un cambio de coloración de rojo a incoloro al formarse el 2-bromohexano.
El segundo método de obtención de halogenuros de alquilo consiste en tratar alcoholes (ROH) o alquenos (R2C=CR2) con hidrácidos. Los hidrácidos tienen por fórmula general HX (HF, HCl, HBr y HI). Se mostrará un ejemplo utilizando etanol para cada uno de ellos:
CH3CH2OH + HF => CH3CH2F + H2O
CH3CH2OH + HCl => CH3CH2Cl + H2O
CH3CH2OH + HBr => CH3CH2Br + H2O
CH3CH2OH + HI => CH3CH2I + H2O
Asimismo, los alquenos pueden adicionar moléculas HX a sus dobles enlaces, formándose halogenuros de alquilo secundarios.
CH2=CH-CH3 + HBr => BrCH2-CH2-CH3 + CH3-CHBr-CH3
El producto BrCH2-CH2-CH3 es el 1-bromopropano, y el CH3-CHBr-CH3 el 2-bromopropano. El segundo es el producto mayoritario por ser el de mayor estabilidad, mientras que el primero se produce en menor proporción por ser más inestable. Esto se debe a que el CH3CHBrCH3 es un halogenuro de alquilo secundario.
Muy similar ocurre cuando lo que se adiciona al alqueno es una molécula de X2:
CH2=CH-CH3 + Br2 => BrCH2-CHBr-CH3
Sin embargo, se obtiene un halogenuro de alquilo con dos átomos de bromo enlazados a carbonos adyacentes; halogenuro de alquilo vecinal. Si, por otro lado, se tuviera a los dos bromos enlazados al mismo carbono, se tendría un halogenuro de alquilo geminal, como el siguiente:
Br2CH-CH2-CH3
Las reactividades de los halogenuros de alquilo estriban en la fragilidad o resistencia del enlace C-X. Cuanto más pesado sea el halógeno, más débil será el enlace, y por tanto, se romperá con mayor facilidad. En una reacción química se rompen enlaces y se forman otros nuevos; se rompen los enlaces C-X, para formar un enlace C-G (G= grupo nuevo).
En términos más apropiados, X actúa como un grupo saliente, y G como un grupo entrante en una reacción de sustitución nucleofílica. ¿Por qué ocurre esta reacción? Porque X, al ser más electronegativo que el carbono, le “roba” densidad electrónica dejándole un déficit de electrones que se traduce como una carga parcial positiva:
Cδ+-Xδ-
Si por las cercanías ronda una especie negativa (:G–) o neutra con un par de electrones disponible (:G), capaz de formar un enlace C-G más estable, X terminará siendo sustituido por G. Lo anterior puede representarse con la siguiente ecuación química:
RX + :G– => RG + X–
Mientras más débil sea el enlace C-X o R-X, mayor será su reactividad o tendencia a ser sustituido por el agente nucleofílico (o nucleófilo) G; es decir, amantes de núcleos o de cargas positivas.
Ejemplos
Se muestra a continuación una serie de ecuaciones generales para las sustituciones nucleofílicas que pueden sufrir los halogenuros de alquilo:
RX + OH– => ROH + X– (Alcoholes)
+ OR’- => ROR’ (Éteres, síntesis de Williamson)
+ I– => RI (Yoduros de alquilo)
+ CN– => RCN (Nitrilos)
+ R’COO– => RCOOR’ (Ésteres)
+ NH3 => RNH2 (Aminas)
+ P(C6H5)3 => RP(C6H5)3+ X– (Sales de fosfonio)
+ SH– => RSH (Tioles)
A partir de estos ejemplos ya puede sospecharse lo valiosos que son los halogenuros de alquilo para las síntesis orgánicas. Una de tantas sustituciones que faltaron por citar es la de la reacción de Friedel Crafts, utilizada para “alquilar” anillos aromáticos:
RX + ArH + AlCl3 => ArR
En esta reacción un H del anillo aromático se sustituye por un grupo R proveniente del RX.
Los halogenuros de alquilo pueden liberar moléculas de HX mediante una reacción de eliminación; específicamente, una deshidrohalogenación:
R2CH-CXR2 + OH– => R2C=CR2 + HX
Se dice que ocurre una deshidrohalogenación porque se pierde tanto un H como un X en una misma molécula de HX.
Los halogenuros de alquilo pueden reaccionar con ciertos metales formando el reactivo de Grignard, utilizado para agregar grupos R a otras moléculas. La ecuación general de su síntesis es la siguiente:
RX + Mg => RMgX
A lo largo de los apartados ya se han mencionado varios ejemplos de halogenuros de alquilo. Algunos otros, simples, son:
-Cloruro de etilo, CH3CH2Cl
-Fluoruro de isopropilo, (CH3)2CH2F
-2-metil-3-cloropentano, CH3-CH(CH3)-CHCl-CH2CH3
-yoduro de secbutilo, CH3CH2CH2I-CH3
-3-bromo-6-yodoheptano, CH3-CH2-CHBr-CH2-CH2-CH2I
-3,4-dibromo-1-penteno, CH3-CHBr-CHBr-CH=CH2
En apartados anteriores se hizo mención de la capacidad disolvente de los halogenuros de alquilo. De dicha propiedad la industria ha sacado provecho para utilizarlos como limpiadores, ya sea para materia textil, componentes electrónicos, o remover manchas de barnices.
Asimismo, se utilizan como disolventes de pinturas, o de muestras orgánicas o grasosas para innumerables tipos de ensayos analíticos.
Los halogenuros de alquilo son muy útiles para “alquilar” anillos aromáticos, a la vez que sirven de fuente de partida para la síntesis de prácticamente todas las demás familias de compuestos orgánicos. Sintéticamente, a RX se le considera una fuente de grupos o cadenas R, las cuales pueden ser deseadas su incorporación a compuestos altamente aromáticos.
Se mencionó al principio que los átomos de halógenos interaccionan con las matrices biológicas, por lo que en nuestros organismos no pueden pasar desapercibidos sin generar un cambio, positivo o negativo. Si un fármaco ejerce un efecto positivo en el cuerpo, al tener un átomo de halógeno dicho efecto puede o no que se incremente.
Entonces, si X está enlazado directamente un carbono con hibridación sp3, se tendrá un halogenuro de alquilo y no un derivado halogenado. Algunos de tales halogenuros se muestran a continuación en la siguiente serie de imágenes:
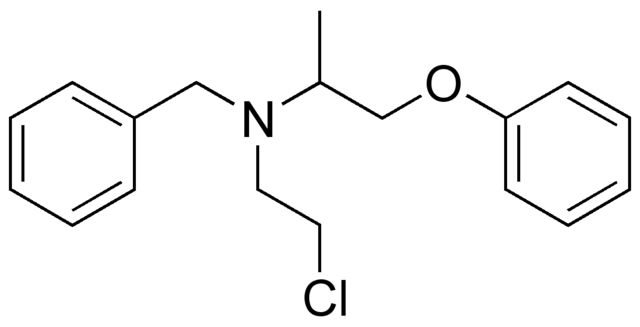
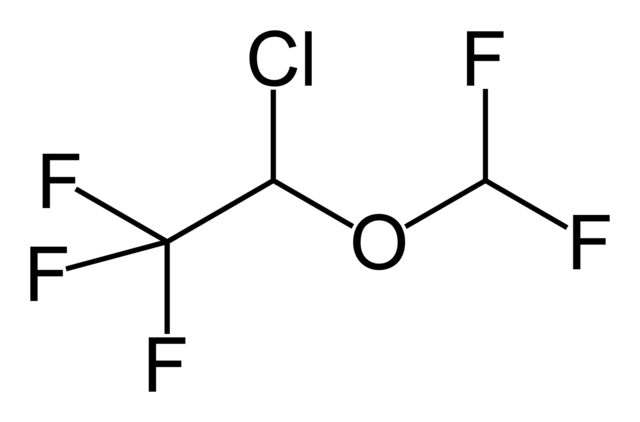
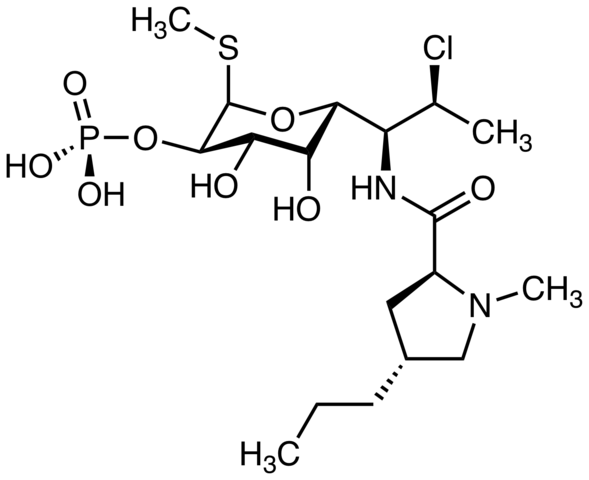
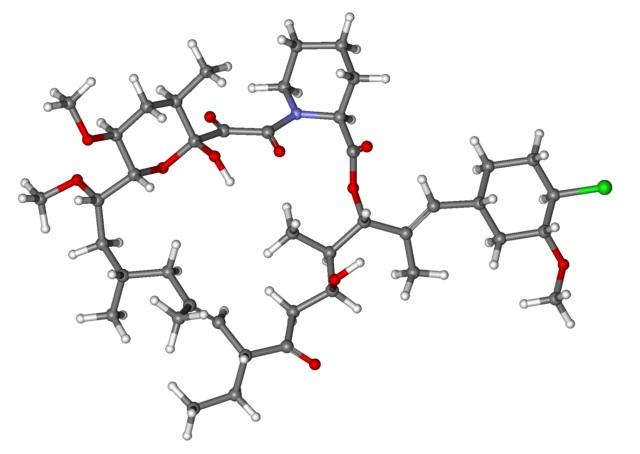
Nótese que en estos cinco fármacos hay, por lo menos, un enlace del tipo CH2-X o CH-X; es decir, el halógeno está unido a un carbono sp3.
El famoso refrigerante freón-12 (CHCIF2), al igual que otros fluoroalcanos o hidrofluorocarbonos, sustituyeron a los gases amoníaco y a los clorofluorocarbonos (CFCs) en esta función porque, aun siendo sustancias no volátiles ni tóxicas, estas destruían la capa de ozono; mientras que el freón-12, por ser más reactivo, se destruye antes de llegar a tales altitudes.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Clark Jim. (14 de julio de 2016). Uses of Alkyl Halides. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Gál, B., Bucher, C., & Burns, N. Z. (2016). Chiral Alkyl Halides: Underexplored Motifs in Medicine. Marine drugs, 14(11), 206. doi:10.3390/md14110206
- Alkyl Halides. Recuperado de: chemed.chem.purdue.edu
- Patkar Prachi. (16 de julio de 2017). All About Alkyl Halides: Properties, Uses, and Much More. Science Struck. Recuperado de: sciencestruck.com
- R. Nave. (2016). Alkyl Halides. Recuperado de: hyperphysics.phy-astr.gsu.edu
- Learning Guide for Chapter 9 – Alkyl Halides I. Recuperado de: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Halogenuros de alquilo: Propiedades, usos y aplicaciones. [PDF. Recuperado de: cvonline.uaeh.edu.mx
