Electronegatividad: qué es, escalas, variación, utilidad y ejemplos
¿Qué es la electronegatividad?
La electronegatividad es una propiedad periódica relativa que concierne a la capacidad de un átomo de atraer densidad electrónica de su entorno molecular. Se trata de la tendencia de un átomo a atraer electrones hacia sí cuando está unido a una molécula. Esto se refleja en el comportamiento de muchos compuestos y en cómo interactúan intermolecularmente unos con otros.
En otras palabras, mientras más electronegativo sea un átomo, mayor capacidad tendrá de atraer electrones de otros átomos; asimismo, tendrá un más alto potencial de ionización, que le permite mantener sus electrones frente a la atracción externa mientras atrae electrones de los átomos circundantes.
Ahora bien, no todos los elementos atraen en igual grado los electrones de los átomos adyacentes. Para el caso de aquellos que ceden densidad electrónica con facilidad, se dice que son electropositivos, mientras que los que se “cubren” de electrones, son electronegativos. Existen muchas maneras de explicar y observar esta propiedad (o concepto).
Por ejemplo, en los mapas de potenciales electrostáticos para una molécula (como la del dióxido de cloro de la imagen superior, ClO2) se observa el efecto de las diferentes electronegatividades para los átomos de cloro y oxígeno.
El color rojo señala las regiones ricas en electrones de la molécula, δ-, y el color azul las que son pobres de electrones, δ+. Así, tras una serie de cálculos computacionales puede establecerse este tipo de mapas; muchos de ellos muestran una relación directa entre la ubicación de los átomos electronegativos y δ-.
También puede visualizarse del siguiente modo: dentro de una molécula es más probable que el tránsito de los electrones ocurra en las cercanías de los átomos más electronegativos.
Es por esta razón que para el ClO2 los átomos de oxígeno (las esferas rojas) se rodean de una nube roja, mientras que el átomo de cloro (la esfera verde) de una nube azulada.
La definición de la electronegatividad depende del enfoque que se le dé al fenómeno, existiendo varias escalas que lo consideran desde diversos aspectos. No obstante, todas las escalas tienen en común que son sustentadas por la naturaleza intrínseca de los átomos.
Escalas de electronegatividad
La electronegatividad no es una propiedad que pueda cuantificarse ni tampoco posee valores absolutos. Esto es porque la tendencia de un átomo de atraer densidad electrónica hacia él no es la misma en todos los compuestos. En otras palabras: la electronegatividad varía en función de la molécula.
Si para la molécula de ClO2 se cambiara el átomo de Cl por el de N, entonces la tendencia del O de atraer los electrones también se modificaría; podría incrementarse (hacerse la nube más roja) o disminuir (perder color). La diferencia radicaría en el nuevo enlace N-O formado, para tener así la molécula O-N-O (dióxido de nitrógeno, NO2).
Como la electronegatividad de un átomo no es igual para todos sus entornos moleculares, es necesario definirla en función de otras variables. De esta manera, se tienen unos valores que sirven como referencia y que permitan predecir, por ejemplo, el tipo de enlace que se forma (iónico o covalente).
Escala de Pauling
El gran científico y ganador de dos premios Nobel, Linus Pauling (1901-1994), planteó en 1932 una forma cuantitativa (medible) de la electronegatividad, conocida como la escala de Pauling. En ella, la electronegatividad de dos elementos, A y B, formando enlaces, estaba relacionada con la energía extra asociada al carácter iónico del enlace A-B.
Teóricamente los enlaces covalentes son los más estables, pues la repartición de sus electrones entre dos átomos es equitativa; es decir, para las moléculas A-A y B-B ambos átomos comparten de igual modo el par de electrones del enlace. Sin embargo, si A es más electronegativo, entonces dicho par estará más de A que de B.
En ese caso, A-B ya no es completamente covalente, aunque si sus electronegatividades no difieren mucho, puede decirse que su enlace tiene un alto carácter covalente. Cuando esto ocurre, el enlace sufre una pequeña inestabilidad y adquiere energía extra como producto de la diferencia de electronegatividad entre A y B.
Mientras más grande es esta diferencia, mayor será la energía del enlace A-B, y en consecuencia mayor será el carácter iónico de dicho enlace.
Esta escala representa la más utilizada en la química, y los valores de las electronegatividades surgieron de la asignación de un valor de 4 para el átomo de flúor (el elemento con menor electronegatividad es el cesio, con 0,7). De allí pudieron calcularse la de los demás elementos.
Escala de Mulliken
Mientras que la escala de Pauling tiene que ver con la energía asociada a los enlaces, la escala de Robert Mulliken (1896-1986) se relaciona más con otras dos propiedades periódicas: la energía de ionización (EI) y la afinidad electrónica (AE).
Así, un elemento con valores altos de EI y AE es muy electronegativo, y por tanto, atraerá electrones de su entorno molecular.
¿Por qué? Debido a que EI refleja qué tan difícil es “arrancarle” un electrón externo, y AE qué tan estable es el anión formado en fase gaseosa. Si ambas propiedades tienen magnitudes altas, entonces el elemento es “amante” de los electrones.
Las electronegatividades de Mulliken se calculan con la siguiente fórmula:
ΧM = ½ (EI + AE)
Es decir, χM es igual al valor promedio de EI y AE.
Sin embargo, a diferencia de la escala de Pauling que depende de qué átomos forman enlaces, esta se relaciona con propiedades del estado de valencia (con sus configuraciones electrónicas más estables).
Ambas escalas generan valores similares de electronegatividad para los elementos y se relacionan aproximadamente con la siguiente reconversión:
ΧP = 1.35(ΧM)1/2 – 1.37
Tanto XM como XP son valores adimensionales; esto es, carecen de unidades.
Escala de A.L. Allred y E. Rochow
Existen otras escalas de la electronegatividad, como la de Sanderson y Allen. Sin embargo, la que sigue a las primeras dos es la escala de Allred y Rochow (χAR). Esta escala se basa en la carga nuclear efectiva que experimenta un electrón en la superficie de los átomos. Por lo tanto, se relaciona directamente con la fuerza atractiva del núcleo y el efecto pantalla.
¿Cómo varía la electronegatividad en la tabla periódica?
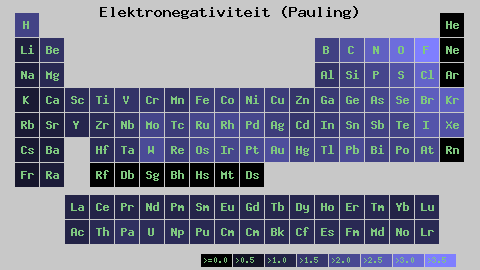
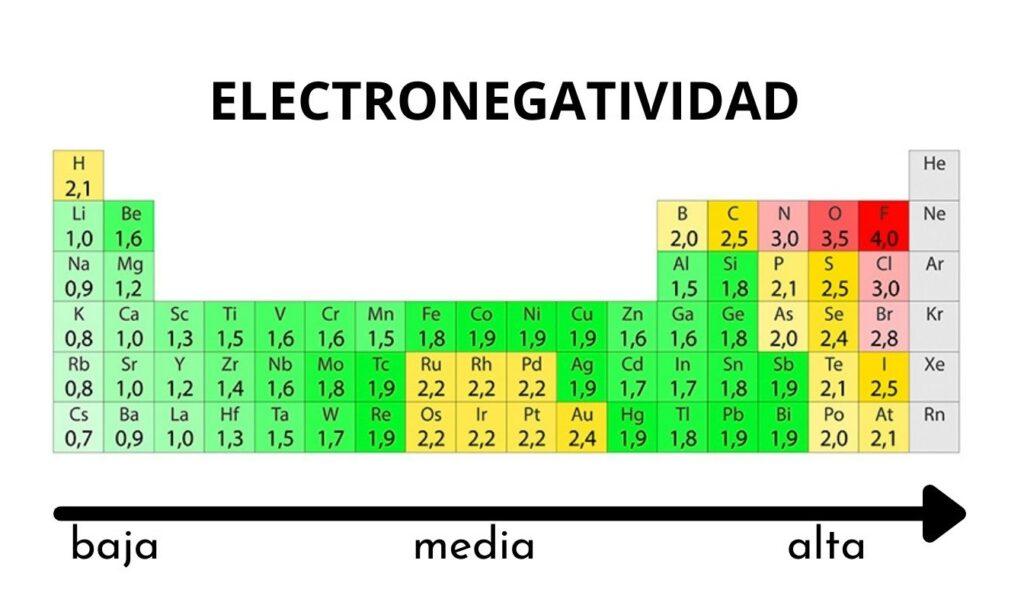
Independientemente de las escalas o de los valores que tenga, la electronegatividad se incrementa de derecha a izquierda por un período, y de abajo hacia arriba en los grupos. Así, esta se incrementa hacia la diagonal superior derecha (sin contar el helio) hasta encontrarse con el flúor.
En la imagen superior puede apreciarse lo recién dicho. En la tabla periódica se expresan las electronegatividades de Pauling en función de los colores de las casillas. Como el flúor es el más electronegativo, le corresponde un color morado más resaltante, mientras que a los menos electronegativos (o electropositivos) colores más oscuros.
Asimismo puede observarse que los cabezales de grupos (H, Be, B, C, etc.) tienen los colores más claros, y que a medida que se desciende por el grupo se oscurecen los otros elementos. ¿A qué se debe esto? La respuesta nuevamente está tanto en las propiedades EI, AE, Zef (carga nuclear efectiva) como en el radio atómico.
El átomo en la molécula
Los átomos individuales tienen una carga nuclear real Z y los electrones externos sufren una carga nuclear efectiva producto del efecto de apantallamiento.
Conforme se desplaza a lo largo de un período, Zef aumenta de tal manera que se contrae el átomo; es decir, se reducen los radios atómicos a lo largo de un período.
Esto trae como consecuencia que, al momento de enlazarse un átomo con otro, los electrones “fluirán” hacia el átomo con mayor Zef. Asimismo, esto otorga un carácter iónico al enlace si existe una marcada tendencia de los electrones a dirigirse hacia un átomo. Cuando no es así, se habla entonces de un enlace predominantemente covalente.
Por esta razón la electronegatividad varía de acuerdo a los radios atómicos, Zef, que a su vez se relacionan estrechamente con EI y AE. Todo es una cadena.
Utilidad de la electronegatividad
La electronegatividad sirve, en principio, para determinar si un compuesto binario es covalente o iónico. Cuando la diferencia de electronegatividad es muy alta (a razón de 1.7 unidades o más) se dice que el compuesto es iónico.
Asimismo, es útil para discernir en una estructura qué regiones posiblemente serán más ricas en electrones.
De aquí puede predecirse qué mecanismo o reacción puede sufrir el compuesto. En regiones pobres de electrones, δ+, es posible que especies cargadas negativamente obren de cierta manera; y en las regiones ricas en electrones, sus átomos pueden interactuar de formas muy específicas con otras moléculas (interacciones dipolo-dipolo).
Ejemplos (cloro, oxígeno, sodio, flúor)
¿Cuáles son los valores de electronegatividad para los átomos de cloro, oxígeno, sodio y flúor? Después del flúor, ¿quién es el más electronegativo? Recurriendo a la tabla periódica se observa que el sodio tiene un color morado oscuro, mientras que los colores para el oxígeno y el cloro resultan visualmente muy parecidos.
Sus valores de electronegatividades para las escalas de Pauling, Mulliken y Allred-Rochow son:
Na (0.93, 1.21, 1.01).
O (3.44, 3.22, 3.50).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Nótese que con los valores numéricos se observa una diferencia entre las negatividades del oxígeno y el cloro.
De acuerdo con la escala de Mulliken, el cloro es más electronegativo que el oxígeno, al contrario de las escalas de Pauling y Allred-Rochow. La diferencia de electronegatividad entre ambos elementos es aún más evidente empleando la escala de Allred-Rochow. Y finalmente, el flúor, sin importar la escala escogida, es el más electronegativo.
Por consiguiente, donde haya un átomo de F en una molécula significa que el enlace tendrá un alto carácter iónico.
Referencias
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición., pág. 30 y 44). Mc Graw Hill.
- Jim Clark. (2000). Electronegativity. Tomado de: chemguide.co.uk
- Anne Marie Helmenstine, Ph.D. (11 de diciembre de 2017). Electronegativity Definition and Examples. Tomado de: thoughtco.com
- Mark E. Tuckerman. (05 de noviembre de 2011). Electronegativity scale. Tomado de: nyu.edu
- Wikipedia (2018). Electronegatividad. Tomado de: es.wikipedia.org
