Cetonas: tipos, propiedades, nomenclatura, usos, ejemplos
Las cetonas son compuestos orgánicos que poseen un grupo carbonilo (-CO). Son compuestos simples en los que el carbono del grupo carbonilo está unido a dos átomos de carbono (y a sus cadenas sustituyentes). Las cetonas son “simples” porque no poseen grupos reactivos como el –OH o –Cl unidos al carbono.
Reconocidas como compuestos polares, las cetonas suelen ser solubles y volátiles, lo que las hace buenos solventes y aditivos para los perfumes. Además, son fáciles de preparar, relativamente estables y poseen una alta reactividad, lo que las ha convertido en un compuesto intermedio casi perfecto para preparar compuestos orgánicos más complejos.
Por último, la eliminación de cetonas del cuerpo humano suele estar asociada con un bajo nivel de azúcar (en casos diabéticos y/o de extremo ayuno), lo cual puede causar problemas graves de salud para el paciente.
Índice del artículo
- 1 Fórmula general de las cetonas
- 2 Tipos de cetonas
- 3 Propiedades físicas y químicas de las cetonas
- 4 Nomenclatura
- 5 Diferencia entre aldehídos y cetonas
- 6 Usos industriales y en vida diaria
- 7 Ejemplos de cetonas
- 8 Referencias
Las cetonas son compuestos carbonilos en los cuales este grupo se encuentra unido a dos grupos de hidrocarburos; estos pueden ser grupos alquilo, grupos de anillos bencenos o ambos.
Se puede representar una cetona simplemente como R-(C=O)-R’, donde R y R’ son dos cadenas de hidrocarburo cualquiera (alcanos, alquenos, alquinos, cicloalcanos, derivados del benceno y otros). No existen cetonas con un hidrógeno unido al grupo carbonilo.
Existe una gran variedad de métodos para la preparación de cetonas en el ámbito industrial y de laboratorio; además, es importante notar que las cetonas pueden ser sintetizadas por diferentes organismos, incluyendo los seres humanos.
En la industria, el método más común para la síntesis de cetonas involucra la oxidación de hidrocarburos, típicamente con el uso de aire. A pequeña escala, las cetonas se suelen preparar a través de la oxidación de alcoholes secundarios, lo cual da como productos una cetona y agua.
Más allá de estos métodos más comunes, las cetonas pueden ser sintetizadas a través de alquenos, alquinos, sales de compuestos nitrogenados, ésteres y muchos otros compuestos, lo cual las hace de fácil obtención.
Existen varias clasificaciones para las cetonas, dependiendo principalmente de los sustituyentes en sus cadenas R. A continuación se nombran las clasificaciones más comunes para estas sustancias:
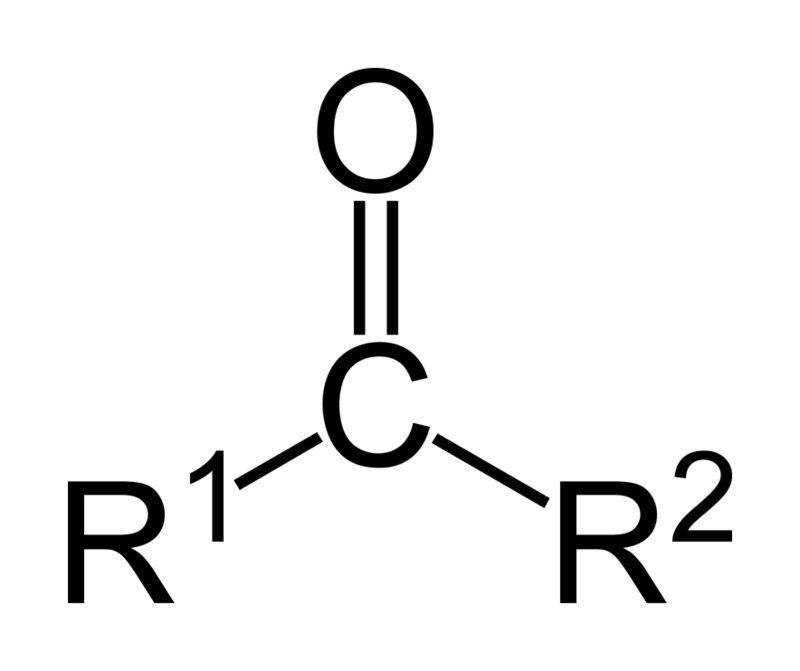
En este caso, la cetona es clasificada por la manera en la que está estructurada su cadena: las cetonas alifáticas son aquellas que poseen dos radicales R y R’ que poseen forma de radicales alquilo (alcanos, alquenos, alquinos y cicloalcanos).
Por su parte, las aromáticas son aquellas que forman derivados del benceno, sin dejar de ser cetonas. Por último, las cetonas mixtas son aquellas que poseen un radical R alquílico y un radical R’ arílico, o viceversa.
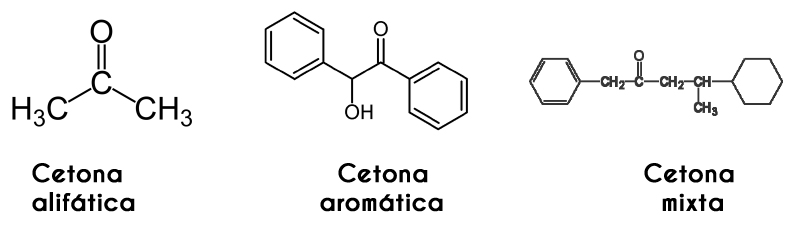
En este caso se estudian los radicales R y R’ sustituyentes del grupo carbonilo; cuando estos son iguales (idénticos) la cetona se hace llamar simétrica; pero cuando son diferentes (como la mayoría de las cetonas), esta se hace llamar asimétrica.
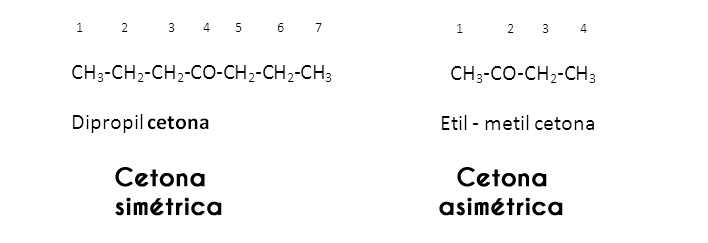
Las cetonas también pueden clasificarse según la saturación de sus cadenas carbonadas; si estas se encuentran en forma de alcanos, la cetona se hace llamar cetona saturada. En cambio, si las cadenas se encuentran como alquenos o alquinos, la cetona se llama cetona insaturada.
Esta es una clase aparte de cetona, puesto que las cadenas de esta cetona poseen dos grupos carbonilo en su estructura. Algunas de estas cetonas poseen características únicas, como una mayor longitud de enlace entre carbonos.
Por ejemplo, las dicetonas derivadas del ciclohexano se conocen como quinonas, las cuales son únicamente dos: la orto-benzoquinona y la para-benzoquinona.
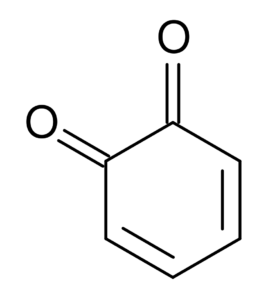
Las cetonas, como la mayoría de los aldehídos, son moléculas líquidas y presentan una serie de propiedades físicas y químicas que varían dependiendo de la longitud de sus cadenas. A continuación se describen sus propiedades:
Las cetonas son altamente volátiles, considerablemente polares y no pueden donar hidrógenos para enlaces de hidrógeno (no poseen átomos de hidrógeno atados a su grupo carbonilo), por lo que presentan puntos de ebullición más altos que los alquenos y éteres, pero más bajos que los alcoholes de su mismo peso molecular.
El punto de ebullición de una cetona aumenta según se incrementa el tamaño de la molécula. Esto se debe a la intervención de las fuerzas de van der Waals y la de dipolo-dipolo, las cuales hacen que se requiera una mayor cantidad de energía para separar los átomos y electrones atraídos dentro de molécula.
La solubilidad de las cetonas tiene una fuerte influencia en parte de la capacidad de estas moléculas para aceptar hidrógenos en su átomo de oxígeno y así formar enlace de hidrógeno con el agua. Además, se forman fuerzas de atracción, de dispersión y dipolo-dipolo entre las cetonas y el agua, las cuales incrementan su efecto soluble.
Las cetonas pierden capacidad de solubilidad mientras más grande sea su molécula, ya que comienzan a requerir más energía para disolverse en agua. También son solubles en compuestos orgánicos.
Gracias a su grupo carbonilo, las cetonas poseen una naturaleza ácida; esto sucede por la capacidad de estabilización por resonancia que posee este grupo funcional, el cual puede ceder protones de su doble enlace para formar una base conjugada llamada enol.
Las cetonas forman parte de un gran número de reacciones orgánicas; esto ocurre por la susceptibilidad de su carbono carbonilo hacia la adición nucleofílica, además de la polaridad de este.
Como se dijo anteriormente, la gran reactividad de las cetonas las hace un reconocido producto intermedio que sirve de base para sintetizar otros compuestos.
Las cetonas se nombran según la prioridad o importancia del grupo carbonilo en la molécula entera, por lo que cuando se tiene una molécula regida por el grupo carbonilo, la cetona se nombra agregando el sufijo “–ona” al nombre del hidrocarburo.
Se toma como cadena principal aquella de mayor longitud que tenga el grupo carbonilo, y luego se nombra la molécula. Si el grupo carbonilo no tiene prioridad sobre los otros grupos funcionales de la molécula, entonces se identifica con “–oxo”.
Para cetonas más complicadas puede identificarse la posición del grupo funcional con un número, y en el caso de dicetonas (cetonas con dos sustituyentes R y R’ idénticos), se nombra la molécula con el sufijo “-diona”.
Finalmente, también puede usarse la palabra “cetona” después de identificar las cadenas de radicales unidas al grupo funcional carbonilo.
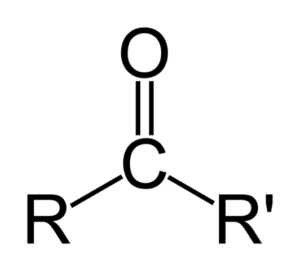
La mayor diferencia entre los aldehídos y las cetonas es la presencia de un átomo de hidrógeno unido al grupo carbonilo en los aldehídos.
Este átomo tiene un efecto importante a la hora de involucrar una molécula en una reacción de oxidación: un aldehído formará un ácido carboxílico o una sal de ácido carboxílico, dependiendo de si ocurre la oxidación bajo condiciones ácidas o básicas.
En cambio, una cetona no posee este hidrógeno, por lo que no ocurren los pasos mínimos necesarios para que se dé la oxidación.
Existen métodos para oxidar una cetona (con agentes oxidantes mucho más poderosos que los típicamente usados), pero estos rompen la molécula de cetona, separándola primero en dos o más partes.
En la industria se observan muchas veces las cetonas en los perfumes y pinturas, tomando papeles de estabilizantes y preservativos que evitan que otros componentes de la mezcla se degraden; también tienen un amplio espectro como solventes en aquellas industrias que fabrican explosivos, pinturas y textiles, además de la farmacéutica.
La acetona (la cetona más pequeña y sencilla) es un solvente muy reconocido mundialmente, y es utilizado como removedor de pintura y thinner.
En la naturaleza las cetonas pueden aparecer como azúcares, llamadas cetosas. Las cetosas son monosacáridos que contienen una cetona por molécula. La cetosa más conocida es la fructosa, el azúcar encontrada en las frutas y la miel.
La biosíntesis de ácidos grasos que se da dentro del citoplasma de las células animales también ocurre por la acción de cetonas. Finalmente, y como se mencionó anteriormente, puede existir una elevación de cetonas en la sangre después del ayuno o en casos diabéticos.
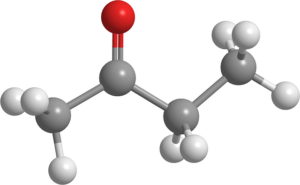
Conocido también como MEK (o MEC), este líquido es producido en gran escala en la industria y es utilizado como solvente.
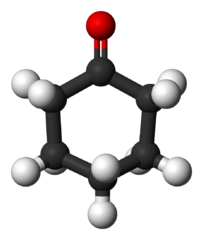
Producida a enorme escala, esta cetona se usa como precursora del material sintético nailon.
Es la hormona principal del sexo masculino y un esteroide anabólico, encontrado en la mayoría de los vertebrados.
Esteroide endógeno y hormona sexual involucrada en el ciclo menstrual, embarazo y embriogénesis en los seres humanos y otras especies.
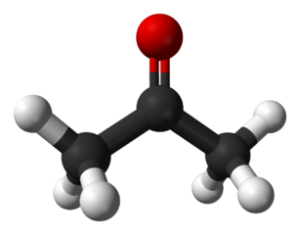
Conocida también como propanona, es un compuesto incoloro utilizado para la fabricación de diversos productos industriales como los plásticos, así como para productos de higiene del hogar y cosméticos como el quitaesmaltes.
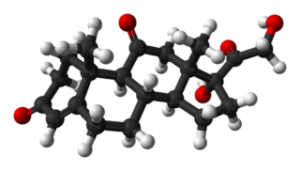
Hormona esteroide utilizada para combatir ciertas dolencias y afecciones como inflamaciones, acné, alergias y otro tipos de reacciones cutáneas, asma o cáncer y leucemia.
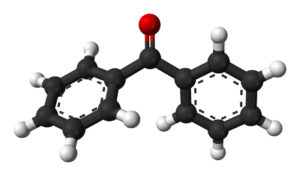
Compuesto muy utilizado en la creación de perfumes y demás productos cosméticos o de protección solar debido su composición aromática.
- Wikipedia. (s.f.). Ketone. Obtenido de en.wikipedia.org
- Britannica, E. (s.f.). Ketone. Obtenido de britannica.com
- University, M. S. (s.f.). Aldehydes and Ketones. Obtenido de chemistry.msu.edu
- ChemGuide. (s.f.). Introducing Aldehydes and Ketones. Obtenido de chemguide.co.uk
- Calgary, U. O. (s.f.). Ketones. Obtenido de chem.ucalgary.ca
