Ácido pícrico: estructura, síntesis, propiedades y usos
El ácido pícrico es un compuesto químico orgánico altamente nitrado cuyo nombre IUPAC es 2,4,6-trinitrofenol. Su fórmula molecular es C6H2(NO2)3OH. Es un fenol muy ácido, y puede encontrarse como picrato de sodio, amonio o potasio; es decir, en su forma iónica C6H2(NO2)3ONa.
Es un sólido de un fuerte sabor de amargo, y de allí deriva su nombre, de la palabra griega ‘prikos’, que significa amargo. Se encuentra como cristales amarillos húmedos. Su desecación o deshidratación es peligrosa, ya que aumenta las propiedades inestables que lo hacen explosivo.
Arriba se muestra la molécula del ácido pícrico. En la imagen es difícil reconocer los enlaces y los átomos debido a que esta corresponde a la representación de su superficie de Van der Waals. En el próximo apartado se aborda con mayor detenimiento la estructura molecular.
A partir del ácido pícrico se sintetizan algunos compuestos intermedios, varias sales de picrato y complejos del ácido pícrico.
El ácido pícrico se emplea como base para la síntesis de colorantes permanentes de tono amarillo. Algunos patólogos e investigadores lo emplean en la fijación o tinción de secciones de tejidos y otros procesos de inmunohistoquimica.
Es muy útil en la elaboración de productos farmacéuticos. Además, se utiliza en la elaboración de fósforos o cerillos y de explosivos. También se emplea para grabar metales, para fabricar vidrio coloreado, y en la determinación colorimétrica de parámetros biológicos como la creatinina.
Por otro lado, el ácido pícrico es irritante al entrar en contacto con la piel, con la mucosa respiratoria, la ocular y la digestiva. Además de lesionar la piel, puede afectar gravemente los riñones, la sangre y el hígado, entre otros órganos.
Índice del artículo
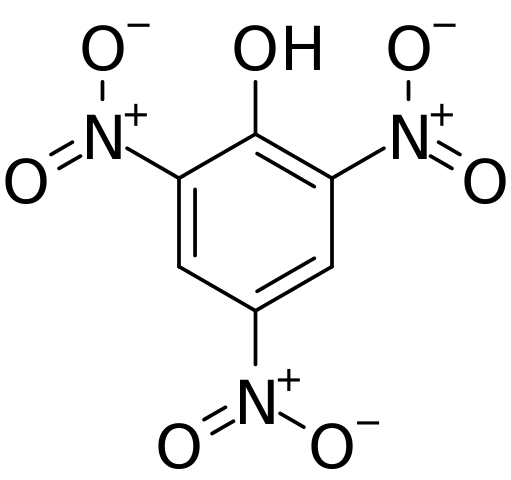
En la imagen superior se muestra con mayor detalle todos los enlaces y la estructura en sí misma de la molécula del ácido pícrico. Consiste de un fenol con tres sustituyentes nitro.
Puede verse que en los grupos NO2 el átomo de nitrógeno tiene una carga parcial positiva, y por lo tanto demanda de densidad electrónica de sus alrededores. Pero, el anillo aromático también atrae los electrones hacia sí, y ante los tres NO2 termina por ceder parte de su propia densidad electrónica.
Como consecuencia de esto, el oxígeno del grupo OH tiende más a compartir uno de sus pares electrónicos libre para surtir la deficiencia electrónica que sufre el anillo; y al hacerlo, se forma el enlace C=O+-H. Esta carga parcial positiva en el oxígeno debilita el enlace O-H, y aumenta la acidez; es decir, se liberará como ion hidrógeno, H+.
Es por esta razón que este compuesto es un ácido excepcionalmente fuerte (y reactivo), aún más que el propio ácido acético. Sin embargo, el compuesto realmente se trata de un fenol cuya acidez sobrepasa la de los otros fenoles; debido, como acaba de mencionarse, a los sustituyentes NO2.
Por lo tanto, al tratarse de un fenol el grupo OH tiene prioridad y dirige la enumeración en la estructura. Los tres NO2 se ubican en los carbonos 2, 4 y 6 del anillo aromático respecto al OH. De aquí deriva la nomenclatura IUPAC para este compuesto: 2,4,6-Trinitrofenol (TNP, por sus siglas en inglés).
Si no estuvieran los grupos NO2, o si hubiera un número menor de ellos en el anillo, el enlace O-H se debilitaría menos, y por tanto el compuesto tendría menor acidez.
Las moléculas del ácido pícrico se ordenan de tal manera que favorezcan sus interacciones intermoleculares; ya sea para la formación de puentes de hidrógeno entre grupos OH y NO2, las fuerzas dipolo-dipolo, o las repulsiones electrostáticas entre las regiones deficientes de electrones.
Podría esperarse que los grupos NO2 se repelieran entre sí y se orientarían en dirección a los anillos aromáticos vecinos. Asimismo, los anillos no podrían alinearse uno encima del otro por un incremento de las repulsiones electrostáticas.
Producto de todas estas interacciones, el ácido pícrico logra formar una red tridimensional que define un cristal; cuya celda unitaria corresponde a un sistema cristalino del tipo ortorrómbico.
Inicialmente se sintetizaba a partir de compuestos naturales como derivados de cuerno animal, resinas naturales, entre otros. A partir de 1841, se ha usado el fenol como precursor del ácido pícrico, siguiendo varias rutas o mediante varios procedimientos químicos.
Como ya se ha dicho, es uno de los fenoles más ácidos. Para sintetizarlo se requiere primero que el fenol sufra un proceso de sulfonación, seguido de un procedimiento de nitración.
La sulfonación del fenol anhidro se realiza al tratar el fenol con ácido sulfúrico fumante, ocurriendo sustituciones electrofílicas aromáticas de H por grupos sulfonatos, SO3H, en la posición -orto y -para respecto al grupo OH.
A este producto, ácido 2,4-fenoldisulfónico, se le efectúa el proceso de nitración, tratándolo con ácido nítrico concentrado. Al hacerlo, los dos grupos SO3H se sustituyen por los grupos nitro, NO2, y entra un tercero en la otra posición nitro. La siguiente ecuación química ilustra esto:
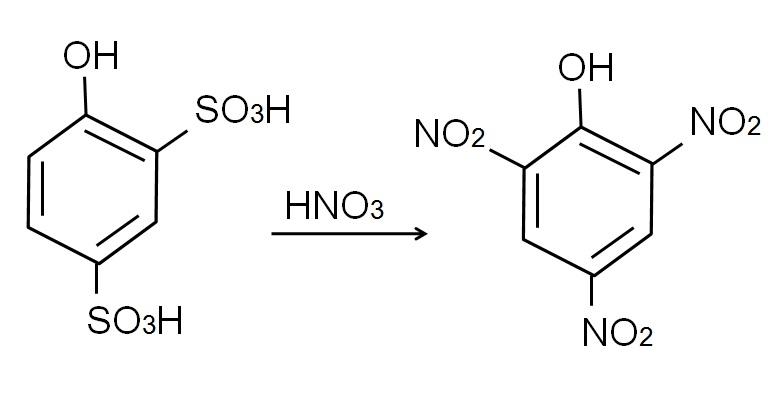
No se puede realizar directamente el proceso de nitración del fenol, ya que se generan alquitranes de peso molecular elevado. Este método de síntesis necesita de un control muy cuidadoso de la temperatura ya que es muy exotérmico:
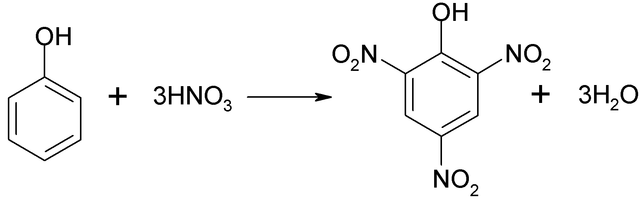
Se puede obtener ácido pícrico al realizar el proceso de nitración directa del 2,4-dinitrofenol, con ácido nítrico.
Otra forma de síntesis es tratando el benceno con ácido nítrico y nitrato mercúrico.
229.104 g/mol.
Masa o suspensión amarilla de cristales húmedos.
Es inodoro.
Es muy amargo.
122.5 °C.
300°C. Pero, al fundirse, explota.
1,77 g/mL.
Es un compuesto moderadamente soluble en agua. Esto se debe a que sus grupos OH y NO2 pueden interactuar con las moléculas de agua mediante puentes de hidrógeno; aunque el anillo aromático es hidrofóbico, y por eso perjudica su solubilidad.
El ácido pícrico es corrosivo en general para los metales, excepto para el estaño y el aluminio.
0,38. Es un ácido orgánico fuerte.
El ácido pícrico se caracteriza por poseer propiedades inestables. Constituye un riesgo para el medio ambiente, es inestable, explosivo y tóxico.
Se debe almacenar bien cerrado para evitar su deshidratación, ya que el ácido pícrico es muy explosivo si se deja secar. Se debe tener mucha precaución con su forma anhidra, porque es muy sensible a la fricción, a los golpes y al calor.
El ácido pícrico se debe guardar en sitios ventilados, frescos, lejos de materiales oxidables. Es irritante al contacto con la piel y las mucosas, no se debe ingerir, y resulta tóxico para el organismo.
El ácido pícrico ha sido muy usado en el área de investigación, en química, en la industria y en el ámbito militar.
Cuando se emplea como fijador de células y tejidos, mejora los resultados de la coloración de estos con tintes ácidos. Sucede con los métodos de coloración tricrómica. Después de haber fijado el tejido con formalina se recomienda una nueva fijación con ácido pícrico.
De esta forma se garantiza una coloración intensa y muy brillante de los tejidos. No se obtienen buenos resultados con tintes básicos. Sin embargo, se deben tomar precauciones, ya que el ácido pícrico puede hidrolizar el ADN si se deja demasiado tiempo.
-En la química orgánica es usado como picratos alcalinos para efectuar identificación y análisis de diversas sustancias.
-Es usado en la química analítica de metales.
-En los laboratorios clínicos se usa en la determinación de los niveles séricos y urinarios de creatinina.
-También ha sido usado en algunos de los reactivos que se emplean para el análisis de los niveles de glucosa.
-A nivel de la industria fotográfica, el ácido pícrico ha sido empleado como sensibilizador en emulsiones fotográficas. Ha formado parte de la elaboración de productos como pesticidas, insecticidas fuertes, entre otros.
-El ácido pícrico se usa para sintetizar otros compuestos químicos intermedios como la cloropicrina y el ácido picramico, por ejemplo. A partir de estos compuestos se han elaborado algunos medicamentos y tintes para la industria del cuero.
-El ácido pícrico llegó a utilizarse en el tratamiento de quemaduras, como antiséptico y otras afecciones, antes que se evidenciara su toxicidad.
-Componente importante por su naturaleza explosiva en la elaboración de fósforos y baterías.
-Por la elevada explosividad del ácido pícrico, ha sido empleado en las plantas de municiones de armamento militar.
-Se ha usado el ácido pícrico prensado y fundido en proyectiles de artillería, en granadas, bombas y minas.
-La sal de amonio del ácido pícrico se ha usado como explosivo, es muy potente pero de menor estabilidad que la TNT. Durante un tiempo fue usado como componente del combustible de los cohetes.
Se ha comprobado que es muy tóxico para el organismo humano y en general para todos los seres vivos.
Se recomienda evitar su inhalación e ingestión, por poseer una toxicidad oral aguda. Asimismo causa mutación en los microorganismos. Presenta efectos tóxicos sobre la fauna silvestre, en mamíferos y en general en el medio ambiente.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Wikipedia. (2018). Picric acid. Recuperado de: en.wikipedia.org
- Purdue University. (2004). Picric acid explosión. Recuperado de: chemed.chem.purdue.edu
- Crystallography 365 project. (10 de febrero de 2014). Less than mellow yellow – the structure of picric acid. Recuperado de: crystallography365.wordpress.com
- PubChem. (2019). Picric Acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Picric Acid. Methuen, London, UK.
