Fuerzas de Van der Waals: qué son, características, tipos, ejemplos
¿Qué son las fuerzas de Van der Waals?
Las fuerzas de Van der Waals son un conjunto de fuerzas de atracción de corto alcance que se dan entre todos los átomos y las moléculas. Reciben su nombre en honor al científico holandés Johannes Diderik Van der Waals.
Estas fuerzas son relativamente débiles, pero aparecen en toda la superficie de contacto entre dos átomos, entre dos moléculas o entre dos superficies, por lo que, si dicha superficie de contacto es grande, las fuerzas de Van der Waals pueden llegar a ser considerables.
La comprensión de las fuerzas de Van der Waals permite predecir de manera cualitativa muchas propiedades físicas de las sustancias químicas, tales como sus puntos de fusión y ebullición y la solubilidad en distintos tipos de solventes. Son estas las fuerzas que permiten explicar cómo es posible que un gas monoatómico como el helio, que no forma ningún tipo de enlace químico, se pueda condensar y pasar al estado líquido.
Estas fuerzas también explican por qué una sustancia como el agua, que está formada por moléculas cuya masa molar es de apenas 18 g/mol, es líquida, mientras que el cloro, que pesa casi 4 veces más, es un gas a temperatura ambiente.
Características de las fuerzas de Van der Waals
Además de representar un tipo de fuerza de atracción entre átomos y moléculas, las fuerzas de Van der Waals no comparten muchas características con los enlaces químicos. A continuación, se presentan las características más sobresalientes de este tipo de fuerzas:
- Son fuerzas dependientes de la distancia. En el caso más sencillo, disminuyen con el cuadrado de la distancia. Además, dependen fuertemente de la geometría molecular.
- En comparación con las fuerzas de atracción que se dan en los enlaces iónicos, covalentes y metálicos, las fuerzas de Van der Waals son relativamente débiles.
- A excepción de las interacciones dipolo-dipolo, son interacciones independientes de la temperatura.
- Son fuerzas de corto alcance, lo que significa que decaen rápidamente a medida que los átomos y moléculas se alejan.
- Son fuerzas generales que se dan entre cualquier átomo y cualquier molécula.
- A diferencia de los enlaces covalentes, no tienen direccionalidad. Esto quiere decir que, sin importar la orientación con la que dos moléculas se acerquen, si se acercan lo suficiente, siempre aparecerán las fuerzas de Van der Waals.
- Cuando dos moléculas o átomos se acercan demasiado, la fuerza se vuelve repulsiva, lo que evita que las moléculas colapsen unas con otras.
- Son aditivas, lo que significa que, a pesar de ser considerablemente débiles, la existencia de muchas interacciones simultáneas puede hacer que la fuerza total de atracción sea considerable.
Tipos de fuerzas de Van der Waals
Además del componente repulsivo que se asegura de que los átomos y moléculas no colapsen, existen tres tipos de fuerzas de Van der Waals, las cuales pueden o no actuar al mismo tiempo entre dos moléculas o átomos. Estas se presentan a continuación:
1. Interacciones dipolo-dipolo o fuerzas de Keesom
La fuerza de Keesom es una de las contribuyentes a la fuerza de Van der Waals. Se trata de las fuerzas de interacción electrostática que aparecen entre los dipolos permanentes de las moléculas polares como el agua, la acetona y otros.
Las fuerzas de Keesom son similares a las fuerzas electrostáticas entre iones, pero se diferencia de estas en que son mucho más débiles y decaen con la sexta potencia de la distancia (es decir, con r6). La razón por la que son más débiles es que la atracción se da entre las cargas parciales de un dipolo, en lugar de entre cargas eléctricas enteras como sucede en el caso de los iones.
Estas interacciones solo se dan entre moléculas y no entre átomos, ya que los átomos no poseen momentos dipolares permanentes. Además, la fuerza de Keesom es inversamente proporcional a la temperatura, lo que significa que, cuando ésta aumenta, la fuerza de Keesom disminuye.
Ejemplos de moléculas que presentan interacciones dipolo-dipolo
Todas las moléculas polares presentan interacciones dipolo-dipolo entre ellas. Por ejemplo:
- Dos moléculas de acetona.
- Dos moléculas de cloroformo.
- Una molécula de ciclohexanona con una molécula de acetona.
2. Interacciones dipolo-dipolo inducido o fuerzas de Debye
Cuando una molécula polar se acerca a un átomo o a una molécula apolar, el dipolo de la primera atrae o repela a los electrones en la superficie de la segunda. Esto induce un dipolo en la molécula apolar, al cual se le denomina dipolo inducido. El nuevo dipolo formado, luego interacciona con el dipolo original creándose una pequeña fuerza de atracción.
A estas interacciones entre un dipolo permanente y uno inducido se le suele conocer como fuerzas de Debye, y dependen no solo de la distancia entre las dos moléculas o entre la molécula polar y un átomo individual, sino también dependen de la polarizabilidad de la molécula apolar y de la magnitud del momento dipolar de la molécula polar.
Ejemplos de moléculas que presentan interacciones dipolo-dipolo inducido
Esta clase de interacciones solo se da entre moléculas diferentes, ya que se necesita que una sea polar y que la otra no. Algunos ejemplos son:
- Un átomo de un gas noble como el argón y un compuesto polar tal como el cloruro de hidrógeno. En este caso, la carga parcial positiva en el hidrógeno del HCl atrae a los electrones de valencia del argón, generando un pequeño dipolo inducido en este último. Si un argón se acerca al átomo de cloro, la carga parcial negativa repelará a los electrones de valencia y también se forma un dipolo inducido.
- El bromo molecular (Br2) es considerablemente soluble en agua, a pesar de tratarse de un compuesto apolar y el agua de un solvente fuertemente polar. La explicación se debe, en parte, a la alta polarizabilidad del bromo que le permite formar interacciones de Debye considerablemente fuertes.
3. Interacciones dipolo inducido-dipolo inducido o fuerzas de dispersión de London
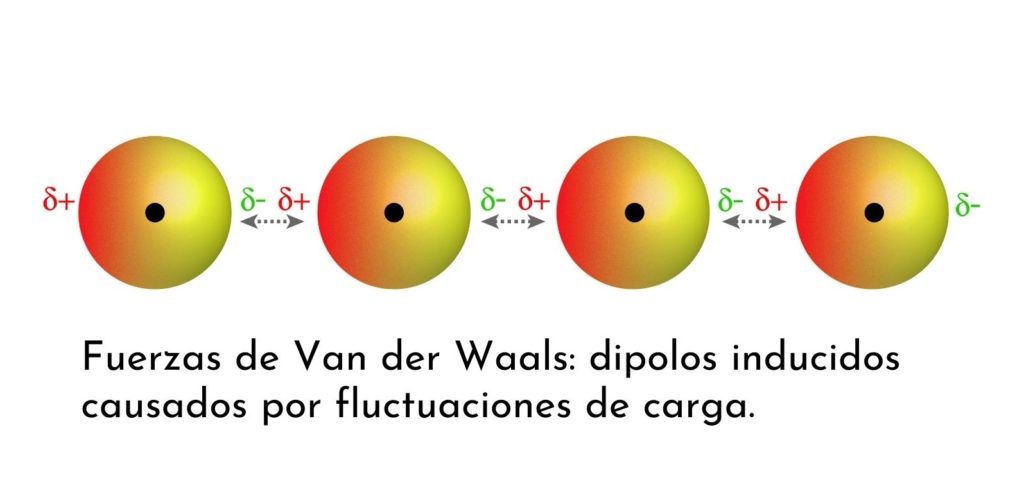
De todas las fuerzas de Van der Waals, las más débiles son las fuerzas de dispersión de London. Estas interacciones se dan entre todos los átomos y moléculas debido a la aparición de dipolos instantáneos en cualquier parte de su estructura.
Un dipolo instantáneo es un pequeño dipolo que se forma por una distribución asimétrica de los electrones de valencia en un momento dado.
¿Cómo se generan los dipolos instantáneos?
Como los electrones se encuentran girando alrededor del núcleo, puede ocurrir que en un momento haya más electrones de un lado que del otro, lo que da origen a un dipolo. Este pequeño dipolo desaparece rápidamente a medida que los electrones siguen moviéndose alrededor del núcleo, y por eso se les llama instantáneos.
Los dipolos instantáneos pueden surgir en cualquier parte de la estructura de una molécula y en cualquier momento dado puede haber muchos de ellos. Las fuerzas de dispersión de London consisten en la interacción entre estos momentos instantáneos en una molécula y los de otra.
Ejemplos de compuestos que presentan fuerzas de dispersión de London
Como se mencionó, este tipo de interacciones se dan entre todos los átomos y moléculas. Sin embargo, es en las moléculas apolares grandes donde su efecto se puede observar mejor, ya que en estos casos es el único tipo de interacción intermolecular que se da.
Un ejemplo típico en el que estas fuerzas son muy intensas es en el caso de los hidrocarburos alifáticos de cadena larga, especialmente en los polímeros como el polietileno.
