Compuesto químico: concepto, tipos, elementos, ejemplos

¿Qué es un compuesto químico?
Un compuesto químico es una sustancia formada por la unión de dos o más átomos de elementos químicos distintos. Los compuestos químicos se mantienen unidos gracias a los enlaces químicos, los cuales se relacionan con los electrones de los átomos enlazados; es decir, en un compuesto químico los electrones (más externos) de los átomos intervienen en la formación de los enlaces.
Los componentes de los compuestos químicos (los elementos químicos) no pueden ser separados unos de otros por métodos físicos, como por ejemplo: destilación, centrifugación, filtración, etc., requiriéndose en su lugar métodos químicos para lograrlo.
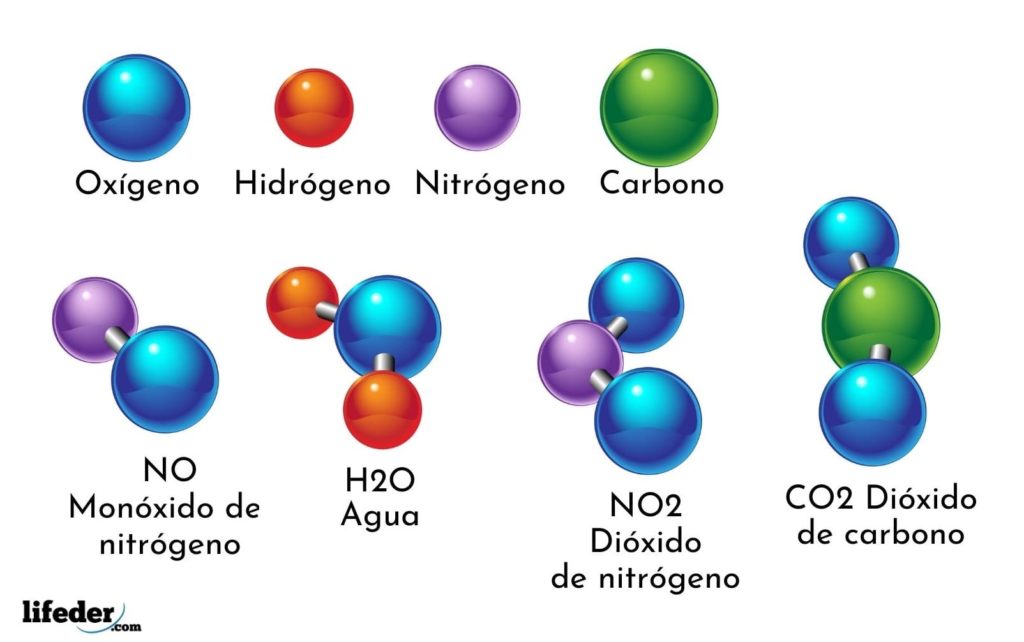
Un ejemplo de compuesto químico es el agua. Está formada por solo dos átomos de dos elementos químicos diferentes: oxígeno e hidrógeno, teniendo la fórmula química H2O. Por lo tanto, dos H se unen con un O para formar H2O.
Un elemento químico, a diferencia de los compuestos químicos, es la forma más sencilla y básica que constituye la materia. Se presenta como un tipo único de átomo que no puede ser descompuesto en sustancias más simples por reacciones químicas.
Tipos de compuestos químicos
Los compuestos químicos pueden ser clasificados principalmente siguiendo dos criterios:
- Según el tipo de enlace que une a los elementos químicos presentes en el compuesto químico.
- Según a la composición y estructura del compuesto químico.
Según el tipo de enlace
Según el tipo de enlace los compuestos químicos pueden ser:
- Moléculas. Son compuestos químicos formados por dos o más tipos de elementos químicos distintos, los cuales se unen mediante un enlace covalente. Este enlace se caracteriza por la compartición de uno o más pares de electrones externos, o de valencia, entre dos átomos.
- Iones. Los compuestos químicos cargados eléctricamente reciben el nombre de compuestos químicos iónicos, y sus iones están unidos por el enlace iónico. Este enlace se produce al unirse un elemento químico del tipo metal con un elemento químico no metal.
- Compuestos intermetálicos. Es un tipo de aleación metálica que constituye un material sólido que se ubica entre dos o más elementos químicos metálicos para mantenerlos unidos.
- Coordinación. Están formados por un elemento metálico central, llamado centro de coordinación, y que le rodean un conjunto de moléculas o iones unidos conocidos como ligandos. La hemoglobina, por ejemplo, es una proteína que se encuentra en los glóbulos rojos y que transporta el oxígeno en la sangre. La hemoglobina tiene un compuesto de coordinación que se llama grupo hemo. En el centro del hemo hay un átomo de hierro que interviene en el transporte de oxígeno por la hemoglobina.
Según la composición y estructura
Según este criterio los compuestos químicos se clasifican en orgánicos e inorgánicos.
- Compuestos orgánicos. Son compuestos cuyo principal elemento químico es el carbono, el cual suele formar enlaces con átomos del mismo carbono y el hidrógeno. No obstante, también están presentes, aunque en menor proporción, el oxígeno, el nitrógeno, el azufre, el boro, el fósforo, etc. Los compuestos orgánicos pueden ser:
- Alifáticos. Las moléculas de los compuestos alifáticos pueden tener formas lineales o cíclicas, es decir, en formas cerradas como triángulos, cuadrados, pentágonos, etc. Pueden presentar enlaces de carbono de tres tipos: simples (C-C), dobles (C=C) o triples (C≡C).
- Aromáticos. Son compuestos cíclicos que presentan en forma alternada enlaces de carbono-carbono sencillos y enlaces dobles carbono-carbono.
- Heterocíclicos. Son compuestos que tienen una estructura cíclica, los cuales pueden presentar la sustitución de un átomo de carbono por otro elemento químico (O, S, N, etc.).
- Organometálicos. Son compuestos orgánicos que pueden presentar en su composición elementos metálicos.
- Polímeros. Son moléculas de gran tamaño (macromoléculas) que están formadas por unidades pequeñas e idénticas que se repiten a lo largo del polímero, y que reciben el nombre de monómeros.
- Compuestos inorgánicos. Los compuestos inorgánicos, a diferencia de los orgánicos, no tienen al carbono como el elemento químico central, sino que intervienen en su composición la mayoría de los elementos químicos conocidos. Los compuestos inorgánicos pueden ser:
- Óxidos básicos. Se forman por la reacción de un elemento químico metálico, como sodio, calcio, hierro, cobre, etc., con el oxígeno. Por ejemplo, el óxido de sodio (NaO) es un óxido básico. Reciben el nombre de óxidos básicos porque van a dar origen a las bases o hidróxidos.
- Óxidos ácidos. Se originan por la reacción de un elemento químico no metálico, como cloro, flúor, azufre, bromo, etc., con el oxígeno. Por ejemplo, el óxido brómico (Br2O5) es un óxido ácido. Reciben el nombre de óxidos ácidos porque dan origen a los ácidos.
- Hidruros. Presentan en su composición química la presencia de hidrógeno. Existen dos tipos: los hidruros metálicos y los hidruros no metálicos.
- Metálicos. Se forman por la reacción del hidrógeno, con el estado de oxidación -1, con un metal. Estos compuestos químicos son los únicos en que está presente el hidrógeno con el estado de oxidación -1. Por ejemplo, el CaH2 es el hidruro de calcio.
- No metálicos. Se forman por la reacción del hidrógeno, con estado de oxidación + 1, con un elemento no metálico con su estado de oxidación menor. El hidruro de cloro (HCl) es un gas que cuando se disuelve en el agua origina el ácido clorhídrico.
- Ácidos. Son compuestos químicos inorgánicos, aunque existen ácidos orgánicos, que tienen un pH menor a 7 y tornan al color del papel tornasol a rojo. Pueden ser clasificados en hidrácidos y oxácidos.
- Hidrácidos. Se originan por la reacción del hidrógeno con un no metal para formar un hidruro que al disolverse en agua origina un ácido; por ejemplo, el ácido yodhídrico (HI).
- Oxácidos. Se origina por la reacción de un óxido de un elemento químico no metálico con el agua. Por ejemplo, la reacción del óxido sulfúrico (SO3) con el agua produce el ácido sulfúrico (H2SO4).
- Sales. Son compuestos químicos que se originan por la interacción de compuestos ácidos y básicos. En su composición puede haber tantos elementos metálicos como no metálicos. Las sales se clasifican en:
- Sales neutras. Se originan en una reacción de neutralización entre un ácido y una base con la formación de la sal y el agua. Por ejemplo, la reacción del hidróxido de sodio (NaOH) con el ácido clorhídrico (HCl) produce el cloruro de sodio (NaCl), una sal y agua. Se llaman neutras porque no producen una variación de pH.
- Sales ácidas. Se forman por la reacción de un hidróxido de un metal con valencia +1, con un ácido con varios hidrógenos. La reacción del hidróxido de litio (LiOH) con el ácido carbónico (H2CO3), produce la sustitución de solo un hidrógeno por un litio, lo que origina el bicarbonato de litio (LiHCO3), una sal ácida y agua.
- Sales básicas. Se producen por la reacción de una base que posee más de un grupo OH con un ácido hidrácido, por ejemplo, el ácido clorhídrico. Al reaccionar el ácido con el hidróxido de calcio, Ca(OH)2, un átomo de cloro sustituye a un grupo hidroxilo (OH). Esto produce hidroxicloruro de calcio (CaClOH), una sal básica y agua.
Diferencias entre los compuestos químicos y los elementos químicos
Cada elemento químico se corresponde con un átomo específico y solo con ese tipo de átomo; es decir, un elemento químico no tiene diferentes tipos de átomos. El átomo es la partícula elemental de la materia que no se divide por métodos físicos ni químicos.
El átomo de un elemento químico puede unirse con los átomos de otros elementos químicos para formar los compuestos químicos, los cuales sí pueden separarse en sus componentes (elementos químicos) utilizando métodos químicos.
Podría equiparse los elementos químicos y los compuestos químicos con un rompecabezas: las piezas del rompecabezas tienen diferentes características, por lo que pueden equipararse a los elementos químicos.
Las piezas del rompecabezas pueden unirse para formar diferentes figuras. Las figuras formadas podrían equipararse con los compuestos químicos. Una vez terminada la actividad, las figuras del rompecabezas pueden separarse en las piezas que lo constituyen.
Ejemplos de compuestos químicos
A continuación puedes ver una serie de ejemplos de compuestos químicos cotidianos:
- HCl: Ácido clorhídrico
- H2S: Ácido sulfhídrico
- HF: Ácido fluorhídrico
- H2SO4: Ácido sulfúrico
- HClO4: Ácido perclórico
- H3PO4: Ácido fosfórico
- H2CO3: Ácido carbónico
- HNO3: Ácido nítrico
- NaOH: Hidróxido de sodio
- Ca(OH)2: Hidróxido de calcio
- Fe(OH)2: Hidróxido ferroso
- Fe(OH)3: Hidróxido férrico
- NaH: Hidruro de sodio
- Cu2O: Óxido cuproso
- CuO: Óxido cúprico
- Fe2O3: Óxido férrico
- Cl2O7: Óxido perclórico
- Br2O: Óxido hipobromoso
- I2O3: Óxido hipoyodoso
- NaCl: Cloruro de sodio
- FeCl3: Cloruro férrico
- HCO3: Bicarbonato de sodio
- CH3COONa: Acetato de sodio
- Na2SO4: Sulfato de sodio
- FeSO4: Sulfuro ferroso
- H2O: Agua
- CO2: Dióxido de carbono
- C6H12O6: Glucosa
- C12H22O11: Sacarosa
Otros temas de interés
Química en la vida cotidiana: ejemplos
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2021). Chemical compound. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27 de agosto de 2020). Compound Definition in Chemistry. Recuperado de: thoughtco.com
- Toppr. (s.f.). What is Compound in Chemistry? Types of Chemical Compound. Recuperado de: toppr.com
