Hidruros: propiedades, nomenclatura, usos, ejemplos
¿Qué son los hidruros?
Los hidruros son compuestos químicos que resultan de la reacción del hidrógeno con elementos metálicos (sodio, potasio, calcio, etc.) y no metales (cloro, flúor, oxígeno, nitrógeno, carbono, etc.). El hidrógeno reacciona con casi todos los elementos químicos, por lo que los hidruros son sustancias muy diversas.
Sus fórmulas generales pueden ser el tipo MHn, donde M es el metal y n su valencia (+1, +2, +3), como por ejemplo el hidruro de aluminio, AlH3; o del tipo EHn o HnE, donde E es un elemento no metálico y n su valencia, como el NH3 o H2S.
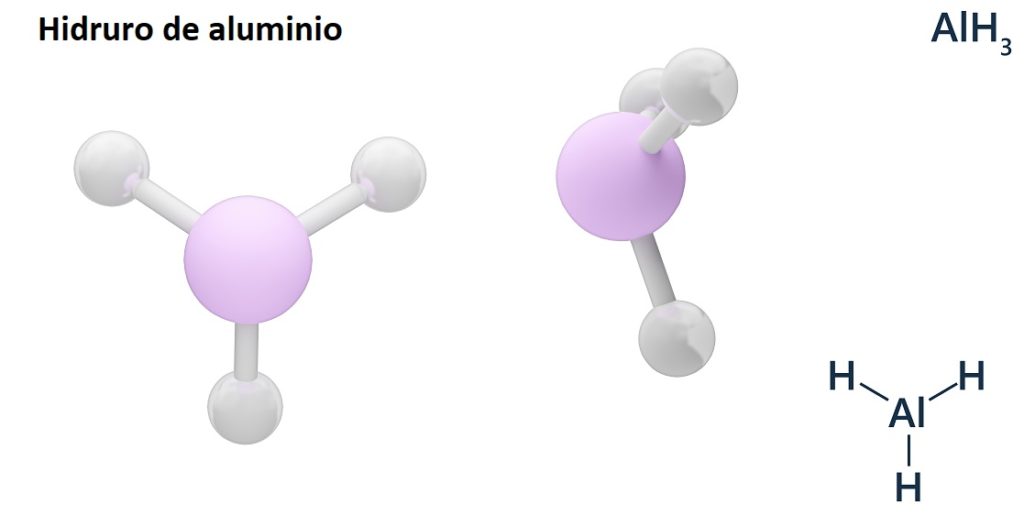
Los hidruros usualmente son compuestos binarios, es decir, resultan de la combinación del hidrógeno con otro elemento químico. Sin embargo, el hidrógeno también puede establecer combinaciones con varios elementos químicos, para formar así hidruros más complejos. Todos los hidruros aquí explicados serán binarios, tales como AlH3 y NaH.
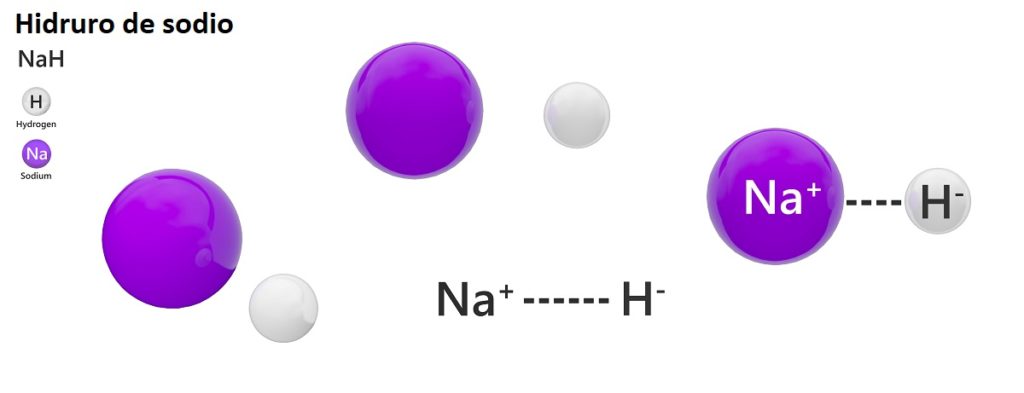
Hay tres tipos de hidruros según la naturaleza de su enlace químico: iónicos, moleculares y metálicos. Los hidruros iónicos o salinos están caracterizados por la presencia de un enlace iónico. Este enlace consiste en la atracción eléctrica entre la carga positiva de un metal alcalino (Na+) o alcalino-térreo (Mg2+), y la carga negativa del anión hidruro (H–).
Los hidruros moleculares, en cambio, se caracterizan por la formación de un enlace covalente entre el hidrógeno y un elemento no metálico. Entre los elementos no metálicos que forman hidruros están: el cloro, el bromo, el flúor, el yodo, el oxígeno y el nitrógeno.
Y los hidruros metálicos resultan de la combinación del hidrógeno con algunos metales de transición. Este tipo de hidruros, a diferencia de los anteriores, tienen estructuras complejas y no se explicarán aquí.
Propiedades de los hidruros
Las propiedades de los hidruros varían dependiendo del tipo de hidruro: iónico, molecular o metálico, por lo que sus propiedades deben señalarse por separado.
Hidruros iónicos o salinos
Son sólidos blancos cristalinos, pero por la presencia de impurezas adquieren un color grisáceo. Estos hidruros no son solubles en los solventes comunes, como agua, alcohol, etc. Tienen además puntos de ebullición y de fusión altos.
Presentan una densidad alta y en estado fundido pueden conducir la electricidad.
Los hidruros iónicos se consideran de naturaleza básica o alcalina, ya que disueltos en el agua forman hidróxidos y liberan hidrógeno molecular:
NaH + H2O → H2 + NaOH
La reacción del hidruro iónico con el agua es muy vigorosa y peligrosa: produce hidrógeno en forma gaseosa, el cual es un material combustible e inflamable.
Los hidruros iónicos asimismo pueden reaccionar con haluros de metales, formados por un metal y un no metal conocido como halógeno ( MX, X= F, Cl, Br, I):
4 LiH + AlCl3 → LiAlH4 + 3 LiCl
El LiH (hidruro de litio) es un compuesto binario; mientras que el LiAlH4 (hidruro de litio y aluminio) es un compuesto ternario, es decir, está formado por tres elementos químicos.
Hidruros moleculares o covalentes
Se encuentran en estado líquido o gaseoso a diferencia de los hidruros iónicos, que son sólidos. Tienen bajos puntos de ebullición y fusión, observándose que al aumentar el peso molecular del hidruro aumenta el punto de ebullición; a excepción del amoníaco (NH3), el agua (H2O) y el hidruro de flúor (HF).
Los hidruros covalentes son conductores pobres de la electricidad y muchas de sus propiedades se deben a la formación de los puentes de hidrógeno. Los hidruros covalentes son considerados como ácidos, ya que disueltos en el agua pueden originan ácidos, por ejemplo, el ácido clorhídrico.
Hidruros metálicos
Se encuentran en estado sólido, presentando el tono oscuro de los metales. Son buenos conductores de la electricidad y tienen superficies lustrosas. Los hidruros metálicos que son estables en el aire se tornan reactivos cuando se calientan, por ejemplo, el hidruro de uranio (UH3) presenta esta propiedad.
Nomenclatura
La forma de nombrar a los hidruros es simple, y no varía demasiado en ninguna de las nomenclaturas. Si el metal o el elemento no metálico tienen más de una valencia, esta se especifica entre paréntesis y con número romano de acuerdo a la nomenclatura stock.
Por ejemplo, el FeH3 se llama hidruro de hierro (III), y el CoH2 hidruro de cobalto (II). Estos mismos hidruros pueden nombrarse también utilizando la nomenclatura sistemática, la cual hace uso de los prefijos numeradores griegos (di, tri, tetra, etc.). Así, el FeH3 se llama trihidruro de hierro, y el CoH2 dihidruro de cobalto.
La nomenclatura clásica no es muy utilizada para los hidruros. Por ejemplo, al NaH se le conoce más como hidruro de sodio, y no hidruro sódico.
¿Cómo se forman los hidruros?
Hidruros iónicos o salinos
Se forman por la reacción del hidrógeno con un metal perteneciente al grupo de los metales alcalino o al grupo de los metales alcalino-térreos.
En los hidruros formados con estos metales el hidrógeno se encuentra en la forma H–, conocido como el anión hidruro.
Los metales alcalinos (litio, sodio, potasio, rubidio y cesio) reaccionan con el hidrógeno para formar sus correspondientes hidruros:
2 M(l) + H2(g) → 2MH(s)
El metal M al reaccionar se encuentra en estado líquido, y el hidrógeno en estado gaseoso, por lo que la reacción requiere de temperaturas elevadas y presiones altas. Considérese el siguiente ejemplo:
2 Li (l) + H2 (g) → 2 LiH (s)
La reacción del hidrógeno con los metales alcalino-térreos (berilio, magnesio, calcio, estroncio y bario), para la formación de hidruros, es semejante a la observada con los metales alcalinos.
El magnesio y el berilio forman hidruros, pero sus enlaces con el hidrógeno son del tipo covalente; es decir, no iónicos, a diferencia de los demás metales alcalinotérreos:
Ca (l) + H2 (g) → CaH2 (s)
Hidruros moleculares
El hidrógeno puede reaccionar con los no metales, correspondientes a los grupos 14, 15, 16 y 17 de la Tabla Periódica, para formar hidruros moleculares. Considérese por ejemplo la formación del hidruro de flúor mediante la combinación o mezcla directa del hidrógeno con el flúor:
H2 (g) + F2 (g) → 2 HF (g)
El HF se conoce más como fluoruro de hidrógeno, pero también se llama hidruro de flúor.
Asimismo, el hidrógeno puede reaccionar con el oxígeno (grupo 16 de la Tabla Periódica) siguiendo el mismo esquema:
2 H2 (g) + O2 (g) → 2 H2O (g)
La reacción requiere de suministro de calor para producir el óxido de hidrógeno (agua) o hidruro de oxígeno.
Asimismo, el hidrógeno puede reaccionar con el nitrógeno, perteneciente al grupo 15 de la Tabla Periódica para formar el hidruro de nitrógeno, más conocido como amoníaco (NH3).
N2 (g) + 3 H2 (g) → 2 NH3 (g)
La reacción requiere del suministro de calor, presión elevada y de la presencia de catalizadores (aceleran las reacciones químicas).
Hidruros metálicos
Se forman por la reacción de los metales de transición (grupos 3, 4, 5, 6, 10, 11 y 12 de la Tabla Periódica) con el hidrógeno. Sin embargo, los metales de transición de los grupos 7, 8 y 9 no forman compuestos con el hidrógeno, fenómeno conocido como brecha de hidruro o hydride gap.
Una característica única de los hidruros de los metales transicionales es que no presentan siempre una proporción fija entre el número de átomos de hidrógeno y el número de los átomos presentes en el hidruro. Es decir, que sus fórmulas y estructuras no son simples de representar.
Usos/aplicaciones de los hidruros

Los hidruros están presentes en las baterías de hidruro metálico de níquel (NiMH), usadas conjuntamente con metales de tierras raras, cobalto o manganeso. Se han examinado varios hidruros metálicos para su uso en automóviles eléctricos impulsados por celdas combustibles relacionadas con el hidrógeno.
Agentes reductores
El hidruro de litio y el borohidruro de sodio (NaBH4) se utilizan como agentes reductores químicos en reacciones de síntesis orgánicas.
Almacenamiento de hidrógeno y otros usos relacionados
Existen pruebas pilotos del uso del hidrógeno como combustible en vehículos automotores, pero debido a su explosividad se ha limitado su uso como combustible. Se ha propuesto el uso de los hidruros como una forma de almacenamiento de hidrógeno, para controlar así su peligrosidad.
Además, se han utilizado los hidruros para la purificación y separación del hidrógeno y en los sensores de temperatura.
Desecantes
El hidruro de calcio se utiliza para remover el agua presente en solventes orgánicos.
Ácidos originados de hidruros moleculares
Por ejemplo: el ácido clorhídrico se forma por la disolución en un medio acuoso del hidruro de cloro (HCl), usándose el ácido clorhídrico en la eliminación de los óxidos que recubren el hierro, la acidificación de los pozos petroleros, la producción del cloruro de calcio y en tratamiento de minerales.
Fertilizantes
El amoníaco (NH3) es un hidruro que se utiliza como fertilizante líquido y sirve para la síntesis de compuestos con el nitrato de amonio y el sulfato de amonio, que son utilizados como fertilizantes.
El agua
Es el hidruro más importante. Se emplea en muchas industrias con diferentes usos y aplicaciones. El agua es el principal responsable de la existencia de los seres vivos.
Ejemplos de hidruros
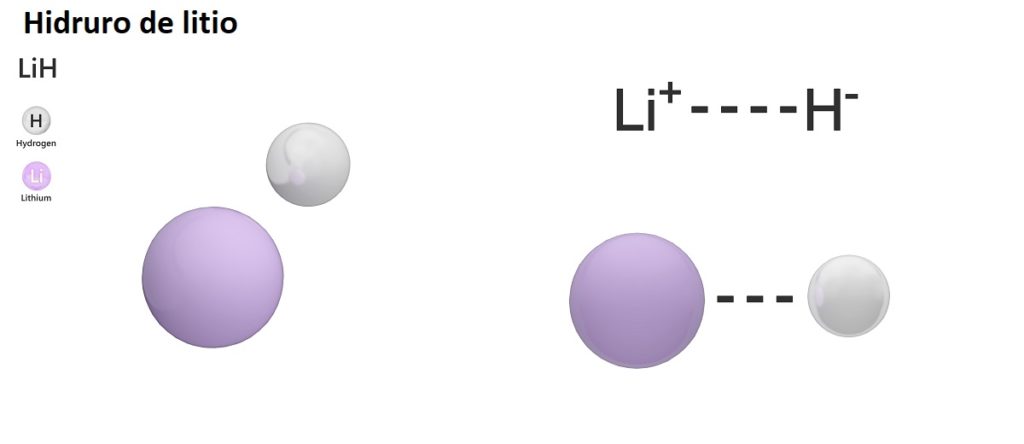
Para finalizar, se enlistarán otros ejemplos de hidruros con sus respectivas fórmulas y nombres:
SnH4: hidruro de estaño | PH3: hidruro de fósforo (fosfina) o trihidruro de fósforo |
KH: hidruro de plomo | MgH2: hidruro de magnesio o dihidruro de magnesio |
KH: hidruro de potasio | CH4: hidruro de carbono o tetrahidruro de carbono (metano) |
CaH2: hidruro de calcio | FeH2: hidruro de hierro (II) |
NaH: hidruro de sodio | ZnH2: hidruro de cinc |
LiH: hidruro de litio | BaH2: hidruro de bario |
CsH: hidruro de cesio | BH3: hidruro de boro (borano) |
BeH2: hidruro de berilio o dihidruro de berilio | SiH4: hidruro de silicio (silano) |
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wojes, Ryan. (27 de agosto de 2020). What Is a Metal Hydride? Recuperado de: thoughtco.com
- American Elements. (2020). Hydrides. Recuperado de: americanelements.com
- Wikipedia. (2020). Hydride. Recuperado de: en.wikipedia.org
- Tandis Arani. (15 de agosto de 2020). Hydrides. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- The Editors of Encyclopaedia Britannica. (2020). Hydride. Recuperado de: britannica.com
