Enlace iónico: características, cómo se forma y ejemplos
El enlace iónico es un tipo de enlace químico en el que existe una atracción electroestática entre iones con carga opuesta. Es decir, un ion cargado positivamente forma un enlace con un ion cargado negativamente, transfiriéndose electrones desde un átomo a otro.
Este tipo de enlace químico se produce cuando los electrones de valencia de un átomo se traspasan a otro átomo permanentemente. El átomo que pierde los electrones se vuelve un catión (cargado positivamente), y el que gana electrones se vuelve un anión (cargado negativamente).
Índice del artículo
- 1 Concepto de enlace iónico
- 2 ¿Cómo se forma un enlace iónico?
- 3 Propiedades del enlace iónico
- 4 Tipos
- 5 Ejemplos de enlaces iónicos
- 6 Ejercicios resueltos
- 7 Referencias
El enlace iónico es aquel por el cual las partículas cargadas eléctricamente, llamadas iones, interactúan para dar origen a sólidos y líquidos iónicos. Este enlace es el producto de las interacciones electrostáticas entre cientos de millones de iones, y no se limita únicamente a un par de los mismos; es decir, va más allá de la atracción entre una carga positiva hacia una carga negativa.
Considérese por ejemplo el compuesto iónico cloruro de sodio, NaCl, conocido mejor como sal de mesa. En el NaCl predomina el enlace iónico, por lo que se compone de iones Na+ y Cl–. El Na+ es el ion positivo o catión, mientras el Cl– (cloruro) es el ion negativo o anión.
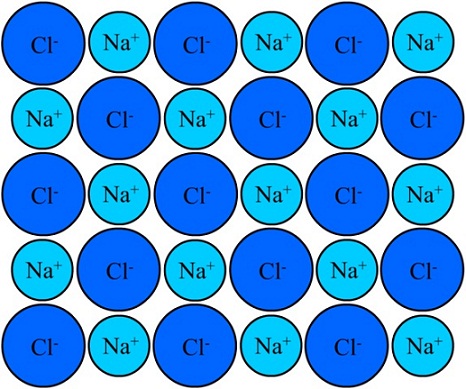
Tanto el Na+ como el Cl– se sienten atraídos por ser de cargas eléctricas opuestas. Las distancias entre estos iones permiten que otros se aproximen, de manera que aparecen pares y pares de NaCl. Los cationes Na+ se repelerán entre sí por ser de cargas iguales, y lo mismo sucede entre sí con los aniones Cl–.
Llega un momento en que millones de iones Na+ y Cl– logran unificarse, cohesionar, para originar una estructura lo más estable posible; una regida por el enlace iónico (imagen superior). Los cationes Na+ son más pequeños que los aniones Cl– a causa de la creciente fuerza nuclear efectiva de su núcleo sobre los electrones externos.

El enlace iónico se caracteriza por establecer estructuras ordenadas donde la distancia entre los iones (Na+ y Cl– en el caso del NaCl) es pequeña en comparación a la de otros sólidos. Se habla pues de una estructura cristalina iónica.
El enlace iónico solamente tiene lugar si ocurre una repartición de electrones para que surjan las cargas de los iones. Este tipo de enlace jamás puede darse entre partículas neutras. Necesariamente tiene que haber cationes y aniones. Pero, ¿de dónde provienen?

Existen muchas vías por las cuales se originan iones, pero en esencia muchas se sustentan en una reacción de oxidación-reducción. La mayoría de los compuestos iónicos inorgánicos constan de un elemento metálico unido con un elemento no metálico (los del bloque p de la tabla periódica).
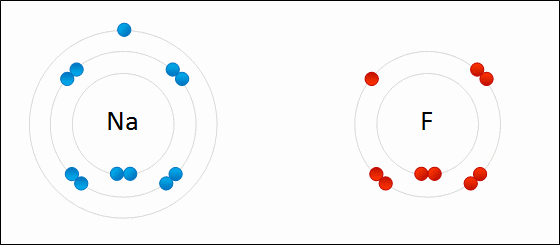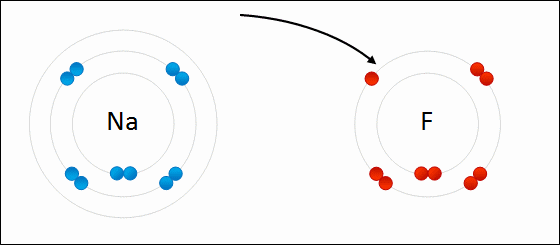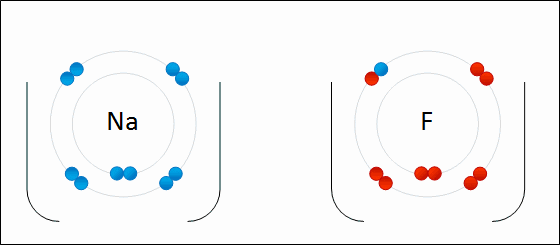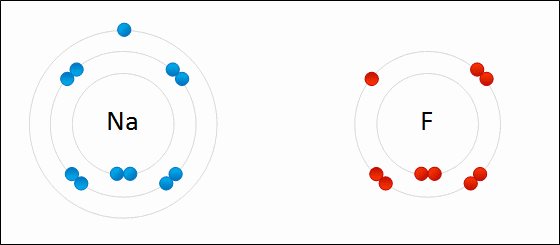
El metal debe oxidarse, perder electrones, para transformarse en un catión. Por otro lado, el elemento no metálico se reduce, gana estos electrones, y se convierte en un anión. La siguiente imagen ilustra este punto para la formación del NaCl a partir de los átomos de sodio y cloro:
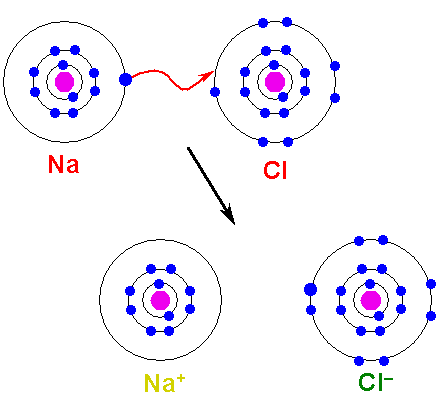
El átomo Na le dona uno de sus electrones de valencia al Cl. Al ocurrir esta repartición de electrones se forman los iones Na+ y Cl–, los cuales comienzan a atraerse inmediata y electrostáticamente.
Se dice por lo tanto que Na+ y Cl– no comparten ningún par de electrones, a diferencia de lo que podría esperarse para un hipotético enlace covalente Na-Cl.
El enlace iónico es no direccional, es decir su fuerza no se hace presente en una única dirección, sino que se propaga por el espacio en función de las distancias que separan a los iones. Este hecho es importante, pues significa que los iones se encuentran fuertemente unidos, lo cual explica varias de las propiedades físicas de los sólidos iónicos.
El enlace iónico es responsable de que la sal funda a una temperatura de 801 ºC. Esta temperatura es considerablemente alta comparada a los puntos de fusión de varios metales.
Esto se debe a que el NaCl debe absorber bastante calor para que sus iones comiencen a fluir libremente fuera de sus cristales; es decir, debe vencerse las atracciones entre Na+ y Cl–.
Los puntos de fusión y ebullición de los compuestos iónicos son especialmente altos producto de sus fuertes interacciones electrostáticas: su enlace iónico. Sin embargo, como este enlace involucra muchos iones, suele adjudicarse este comportamiento más bien a las fuerzas intermoleculares, y no propiamente al enlace iónico.
En el caso de la sal, una vez se haya fundido el NaCl, se obtiene un líquido compuesto de los mismos iones iniciales; solo que ahora se mueven con mayor libertad. El enlace iónico sigue estando presente. Los iones Na+ y Cl– se reúnen en la superficie del líquido para crear una gran tensión superficial, que impide que escapen iones a la fase gaseosa.
Por lo tanto, la sal fundida debe incrementar todavía más su temperatura para hervir. El punto de ebullición del NaCl es 1465 ºC. A esta temperatura el calor sobrepasa las atracciones entre Na+ y Cl– en el líquido, por lo que comienzan a formarse vapores de NaCl con una presión igual a la atmosférica.
Anteriormente se dijo que el enlace iónico se forma entre un elemento metálico y un elemento no metálico. En resumidas cuentas: entre un metal y un no metal. De ordinario esto es así en lo que concierne a los compuestos iónicos inorgánicos; sobre todo, los de tipo binario, como el NaCl.
Para que ocurra una repartición de electrones (Na+Cl–) y no una compartición (Na-Cl), tiene que haber entre ambos átomos una gran diferencia de electronegatividad. De lo contrario, no habría enlace iónico entre ellos dos. Posiblemente el Na y Cl se acercan, interaccionan, pero de inmediato el Cl, por su mayor electronegatividad, le “arrebata” un electrón al Na.
No obstante, este escenario aplica solo para compuestos binarios, MX, como el NaCl. Para otras sales o compuestos iónicos, sus procesos de formación son más complicados y no pueden ser abordados desde una perspectiva meramente atómica o molecular.
No existen distintos tipos de enlaces iónicos, ya que el fenómeno electrostático es puramente físico, variando solamente el modo en que los iones interactúan, o el número de átomos que estos posean; es decir, si se tratan de iones monoatómicos o poliatómicos. Asimismo, cada elemento o compuesto origina un ion característico que define la naturaleza del compuesto.
En el apartado de ejemplos se profundizará sobre este punto, y se verá que el enlace iónico es el mismo en esencia en todos los compuestos. Cuando esto no se cumple, se dice que el enlace iónico presenta cierto carácter covalente, que es el caso de muchas sales de metales de transición, donde los aniones se coordinan con los cationes; por ejemplo, FeCl3 (Fe3+—Cl–).
Se enlistará a continuación varios compuestos iónicos, y se resaltarán cuáles son sus iones y proporciones:
– Cloruro de magnesio
MgCl2, (Mg2+Cl–), en una proporción 1:2 (Mg2+: 2 Cl–)
– Fluoruro de potasio
KF, (K+F–), en una proporción 1:1 (K+: F–)
– Sulfuro de sodio
Na2S, (Na+S2-), en una proporción 2:1 (2Na+: S2-)
– Hidróxido de lito
LiOH, (Li+OH–), en una proporción 1:1 (Li+: OH–)
– Fluoruro de calcio
CaF2, (Ca2+F–), en una proporción 1:2 (Ca2+: 2F–)
– Carbonato de sodio
Na2CO3, (Na+CO32-), en una proporción 2:1 (2Na+: CO32-)
– Carbonato de calcio
CaCO3, (Ca2+CO32-), en una proporción 1:1 (Ca2+: CO32-)
– Permanganato de potasio
KMnO4, (K+MnO4–), en una proporción 1:1 (K+: MnO4–)
– Sulfato de cobre
CuSO4, (Cu2+SO42-), en una proporción 1:1 (Cu2+: SO42-)
– Hidróxido de bario
Ba(OH)2, (Ba2+OH–), en una proporción 1:2 (Ba2+: OH–)
– Bromuro de aluminio
AlBr3, (Al3+Br–), en una proporción 1:3 (Al3+: 3Br–)
– Óxido de hierro (III)
Fe2O3, (Fe3+O2-), en una proporción 2:3 (2Fe3+: 3O2-)
– Óxido de estroncio
SrO, (Sr2+O2-), en una proporción 1:1 (Sr2+: O2-)
– Cloruro de plata
AgCl, (Ag+Cl–), en una proporción 1:1 (Ag+: Cl–)
– Otros
-CH3COONa, (CH3COO–Na+), en una proporción 1:1 (CH3COO–: Na+)
– NH4I, (NH4+I–), en una proporción 1:1 (NH4+: I–)
Cada uno de estos compuestos presenta un enlace iónico donde millones de iones, correspondientes a sus fórmulas químicas, se atraen electrostáticamente y originan un sólido. Mientras mayor sea la magnitud de sus cargas iónicas, más intensas serán las atracciones y repulsiones electrostáticas.
Por lo tanto, un enlace iónico tiende a ser más fuerte cuanto más grandes sean las cargas de los iones que conforman el compuesto.
A continuación se resolverán algunos ejercicios que ponen en práctica los conocimientos básicos del enlace iónico.
¿Cuáles de los siguientes compuestos es iónico? Las opciones son: HF, H2O, NaH, H2S, NH3 y MgO.
Un compuesto iónico debe tener por definición un enlace iónico. Mientras más grande sea la diferencia de electronegatividad entre sus elementos conformantes, mayor será el carácter iónico de dicho enlace.
Por lo tanto, las opciones que no posean un elemento metálico se descartan en principio: HF, H2O, H2S y NH3. Todos estos compuestos están formados solamente por elementos no metálicos. El catión NH4+ es una excepción a esta regla, pues no tiene ningún metal.
Las opciones restantes son NaH y MgO, los cuales poseen respectivamente los metales Na y Mg, unidos a elementos no metálicos. NaH (Na+H–) y MgO (Mg2+O2-) son compuestos iónicos.
Considérese el siguiente compuesto hipotético: Ag(NH4)2CO3I. ¿Cuáles son sus iones y en qué proporción se encuentran en el sólido?
Descomponiendo el compuesto en sus iones tenemos: Ag+, NH4+, CO32- y I–. Estos se unen electrostáticamente siguiendo la proporción 1:2:1:1 (Ag+: 2NH4+: CO32-: I–). Quiere decir que la cantidad de cationes NH4+ es el doble que para los iones Ag+, CO32- y I–.
¿Cuál de los siguientes compuestos se esperaría en principio que tuviera el enlace iónico más fuerte? Las opciones son: KBr, CaS, Na2SO4, CuO, AlPO4 y Pb3P4.
El KBr está compuesto de iones K+ y Br–, con una magnitud de carga. Luego, CaS posee los iones Ca2+ y S2-, con cargas de doble magnitud, por lo que pudiera pensarse que el enlace iónico en CaS es más fuerte que en KBr; y también más fuerte que en Na2SO4, pues este último está compuesto de iones Na+ y SO42-.
Tanto CaS como CuO quizás tengan un enlace iónico igual de fuerte, ya que ambos contienen iones con cargas de doble magnitud. Seguidamente, tenemos al AlPO4, con iones Al3+ y PO43-. Estos iones tienen cargas de triple magnitud, por lo que el enlace iónico en AlPO4 debería ser más fuerte que en todas las opciones anteriores.
Y finalmente, tenemos al ganador Pb3P4, pues si asumimos que está formado por iones, estos vienen a ser Pb4+ y P3-. Sus cargas tienen las mayores magnitudes; y por lo tanto, Pb3P4 es el compuesto que probablemente tenga el enlace iónico más fuerte.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Ionic bonding. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Ionic vs Covalent Bonds – Understand the Difference. Recuperado de: thoughtco.com
- The Editors of Encyclopaedia Britannica. (31 de enero de 2020). Ionic bond. Encyclopædia Britannica. Recuperado de: britannica.com
- Chemicool Dictionary. (2017). Definition of Ionic Bonding. Recuperado de: chemicool.com
