Estado gaseoso: características, ley general, ejemplos
El estado gaseoso es un estado de agregación de la materia en el que las partículas se mantienen unidas mediante interacciones débiles, siendo capaces de desplazarse por todas las direcciones del recipiente que las contiene. De todos los estados físicos de la materia, el gaseoso es el que manifiesta mayor libertad y caos.
Los gases ejercen presión, transportan calor, y están compuestos por cualquier tipo de partículas pequeñas. Nuestra atmósfera y el aire que respiramos es una manifestación del estado gaseoso aquí en la Tierra.

Ejemplos de gases son los gases del efecto invernadero, como el vapor de agua, dióxido de carbono, metano u ozono. El dióxido de carbono que exhalamos en la respiración es otro ejemplo de una sustancia gaseosa.
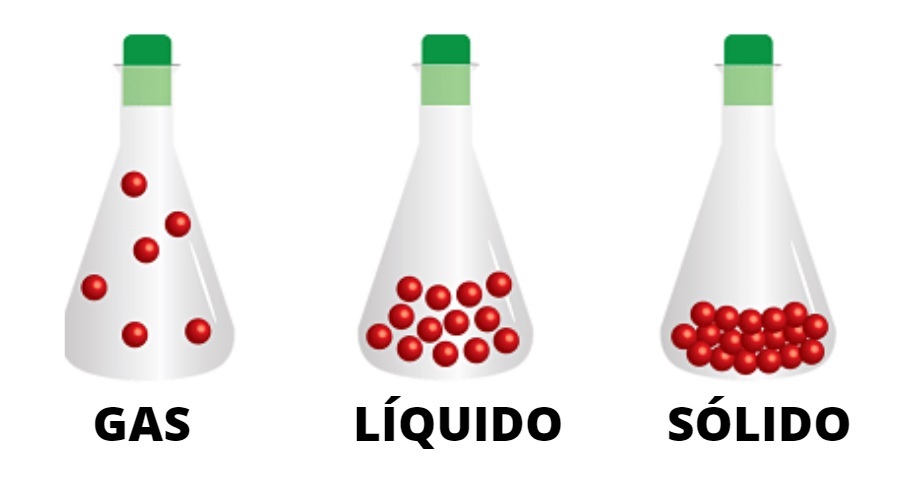
Los líquidos y sólidos, por ejemplo, no se moverán a posiciones más allá de sus propios límites materiales, hecho que no sucede con los gases. El humo de los cigarrillos, de las chimeneas y de las torres, demuestran por sí mismos cómo el gas va ascendiendo y dispersándose por el ambiente sin que nada lo detenga.
Índice del artículo
- 1 Características del estado gaseoso
- 2 Ley general del estado gaseoso
- 3 Ejemplos de estado gaseoso
- 4 Referencias
El estado gaseoso se caracteriza por no tener forma ni volumen definidos. Si no hay fronteras que lo retenga, se dispersará por toda la atmósfera. Incluso como sucede con el helio, escapará fuera de la Tierra.
Un gas solamente puede adquirir la forma que le imponga un recipiente. Si un recipiente es cilíndrico, el gas “tendrá” forma de cilindro.
Este estado se caracteriza también por ser un mal conductor tanto del calor como de la electricidad. Por lo general, es menos denso comparado con los estados sólido y líquido.
Debido a que la mayoría de los gases son incoloros, tales como el oxígeno y el dióxido de carbono, puede determinarse qué tanto de ellos hay en un recipiente mediante la medida de su presión.
Los gases tienden a ser más reactivos, exceptuando los gases nobles, que los líquidos o sólidos, por lo que son potencialmente peligrosos, ya sea por riesgos de incendio, o porque pueden ingresar con mucha facilidad a los sistemas respiratorios de los individuos.
Las partículas gaseosas además suelen ser pequeñas, siendo átomos o moléculas simples.
Por ejemplo, el hidrógeno gaseoso, H2, es una molécula muy pequeña formada por dos átomos de hidrógeno. Asimismo, tenemos al helio, He, cuyos átomos son todavía más pequeños.
Las interacciones en el estado gaseoso son despreciables. En esto se diferencia enormemente de los estados líquido y sólido, en los cuales sus partículas están muy cohesionadas e interaccionan fuertemente entre sí. En las moléculas que forman los estados líquido y sólido apenas existe entre ellas cierto vacío molecular.
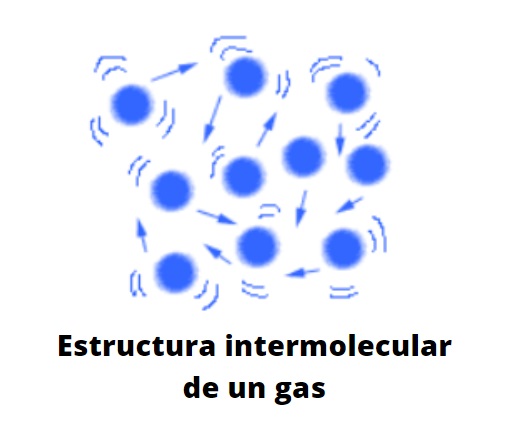
Las partículas en el estado gaseoso se encuentran muy distanciadas unas de las otras, hay mucho vacío entre ellas. Ya no se trata de un vacío a escala molecular. Es tanta la distancia que las separa, que cada partícula en el gas es libre, indiferente de su entorno, a menos que en su trayectoria caótica colisione con otra partícula o contra la pared del recipiente.
Si se asume que no hay recipiente, el vacío entre las partículas del gas puede ser ocupado por el aire, el cual empuja y arrastra el gas hacia la dirección de su corriente. Es por eso que el aire, el cual consiste de una mezcla gaseosa, es capaz de deformar y diseminar por el cielo las sustancias gaseosas, siempre y cuando no sean mucho más densas que él.
El estudio experimental del comportamiento y la mecánica de los gases derivó en varias leyes (Boyle, Charles, Gay-Lussac) que se combinan para poder predecir cuáles serán los parámetros de cualquier sistema o fenómeno gaseosos, es decir, cuáles serán su temperatura, volumen y presión.
Esta ley general tiene la siguiente expresión matemática:
P = KT/V
Donde K es una constante, P la presión, V el volumen, y T la temperatura del gas en escala kelvin. Así, conociendo dos variables (a decir, P y V), puede despejarse la tercera, que vendría a ser la incógnita (T).
Esta ley permite saber, por ejemplo, cuál debe ser la temperatura de un gas, encerrado en un recipiente de volumen V, para exhibir una presión P.
Si a esta ley añadimos el aporte de Amadeus Avogadro, tendremos entonces la ley de los gases ideales, la cual involucra además el número de partículas, y con ellas la concentración molar del gas:
P = nRT/V
Donde n corresponde al número de moles del gas. La ecuación puede reescribirse como:
P = cRT
Donde c es la concentración molar del gas (n/V). Así, de una ley general, se obtiene la ley ideal que describe cómo se relaciona la presión, la concentración, la temperatura y volumen de un gas ideal.
La misma tabla periódica ofrece un buen repertorio de ejemplos de elementos que se presentan en la Tierra como gases. Entre ellos tenemos:
-Hidrógeno

-Helio
-Nitrógeno
-Oxígeno
-Flúor
-Cloro
-Neón
-Argón
-Kriptón
-Xenón
Esto no quiere decir que los demás elementos no puedan llegar a ser gaseosos. Por ejemplo, los metales pueden transformarse en gases si se les someten a temperaturas más altas que sus respectivos puntos de ebullición. Así, puede haber gases de partículas de hierro, mercurio, plata, oro, cobre, circonio, iridio, osmio; de cualquier metal.
En la siguiente lista tenemos algunos ejemplos de compuestos gaseosos:
-Monóxido de carbono, CO

-Dióxido de carbono, CO2 (gas que conforma nuestras exhalaciones)
-Amoníaco, NH3 (sustancia vital para sinfines de procesos industriales)
-Trióxido de azufre, SO3
-Metano, CH4 (gas doméstico, con el que se cocina)
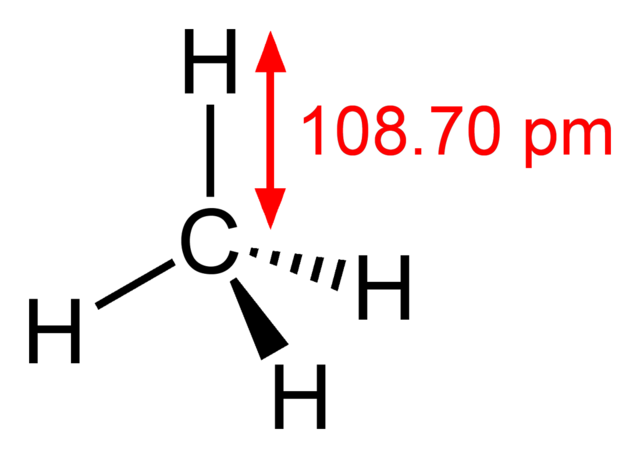
-Etano, CH3CH3
-Dióxido de nitrógeno, NO2 (gas de coloración parda)
-Fosgeno, COCl2 (sustancia altamente venenosa)
-Aire (siendo una mezcla de nitrógeno, oxígeno, argón y otros gases)
-Vapor de agua, H2O (que forma parte de las nubes, los geiseres, los vaporizadores de las máquinas, etc.).
-Acetileno, HC≡CH
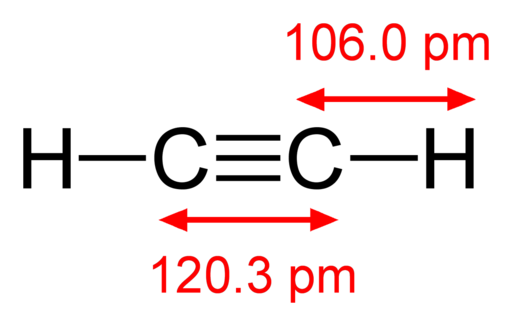
-Vapores de yodo, I2 (gas de coloración morada)
-Hexafluoruro de azufre, SF6 (gas muy denso y pesado)
-Hidrazina, N2H4
-Cloruro de hidrógeno, HCl (que disuelto en agua produce ácido clorhídrico)
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). Gas. Recuperado de: en.wikipedia.org
- Edward A. Mason. (06 de febrero de 2020). Gas. Encyclopædia Britannica. Recuperado de: britannica.com
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Gas Definition and Examples in Chemistry. Recuperado de: thoughtco.com
- María Estela Raffino. (12 de febrero de 2020). ¿Qué es el estado gaseoso? Recuperado de: concepto.de
