Estado líquido: qué es, definición, características, ejemplos

¿Qué es el estado líquido?
El estado líquido es uno de los principales estados físicos que adopta la materia y que se observa abundantemente en la hidrosfera de la Tierra, pero no en lo que respecta al Cosmos y sus incandescentes o heladas temperaturas. Se caracteriza por fluir y ser más compacto que los gases. Por ejemplo, los mares, ríos, lagos y océanos fluyen y se encuentran en estado líquido.
El líquido es el “puente” entre los estados sólido y gaseoso para una sustancia o compuesto determinado; puente que puede ser pequeño o en extremo amplio, lo cual demuestra qué tan estable es el líquido en relación al gas o sólido, y el grado de sus fuerzas de cohesión entre sus átomos o moléculas conformantes.
Se entiende entonces por líquido todo aquel material, natural o artificial, capaz de fluir libremente a favor o en contra de la gravedad. En las cascadas y ríos se aprecia el fluir de las corrientes de agua dulce, así como en el mar el desplazamiento de sus crestas espumosas y su rompimiento en las costas.
El agua es el líquido terrenal por excelencia, y químicamente hablando es el más excepcional de todos. Sin embargo, establecidas las condiciones físicas requeridas, cualquier elemento o compuesto definido puede pasar al estado líquido; por ejemplo, sales y gases líquidos, o un molde refractario llenado con oro fundido.
Características del estado líquido

No tienen forma definida
A diferencia de los sólidos, los líquidos necesitan de una superficie o contenedor para adquirir formas variables.
Es así que por las irregularidades del terreno los ríos “serpentean”, o si se derrama un líquido sobre el piso este se extiende a medida que moja su superficie. Asimismo, llenando a saciedad contenedores o recipientes de cualquier geometría o diseño, los líquidos toman sus formas ocupando todo su volumen.
Presentan superficie dinámica
Los sólidos también adoptan superficies, pero son virtualmente (ya que pueden erosionarse o corroerse) independientes de su entorno o del recipiente que los almacenan. En cambio, la superficie de los líquidos se ajusta siempre a la anchura del recipiente, y su área puede oscilar si se le agita o toca.
Las superficies de los líquidos son dinámicas, se mueven constantemente aun si no puede observarse a simple vista. Si se arroja una piedra a un estanque en aparente calma, se contemplará la aparición de ondas concéntricas que viajan desde el punto en donde cayó la piedra, hacia los bordes del estanque.
Son incomprensibles
Aunque hay excepciones, la mayoría de los líquidos son incomprensibles. Esto significa que se requiere de enormes presiones para reducir sus volúmenes en un modo apreciable.
Son molecularmente dinámicos
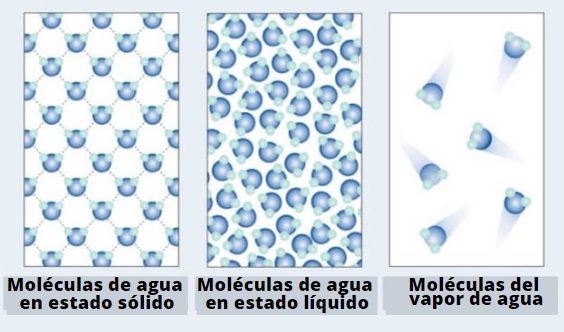
Los átomos o moléculas tienen libertad de movimiento en los líquidos, por lo que sus interacciones intermoleculares no son lo suficientemente fuertes para mantenerlas fijas en el espacio. Este carácter dinámico les permite interactuar solubilizando o no los gases que colisionan con sus superficies.
Presentan tensión superficial

Las partículas del líquido interaccionan en mayor grado entre sí que con las partículas del gas que rondan sobre su superficie. En consecuencia, las partículas que definen la superficie del líquido experimentan una fuerza que las atrae hacia el fondo, la cual se opone a un aumento de su área.
Es por eso que los líquidos cuando se derraman sobre una superficie a la que no pueden mojar, se disponen como gotas, cuyas formas buscan disminuir al mínimo su área y así la tensión superficial.
Son macroscópicamente homogéneos pero pueden ser molecularmente heterogéneos
Los líquidos lucen a simple vista homogéneos, a menos que se traten de algunas emulsiones, suspensiones, o de una mezcla de líquidos inmiscibles. Por ejemplo, si se derrite galio tendremos un líquido plateado por donde se le mire. Sin embargo, molecularmente las apariencias pueden ser engañosas.
Las partículas del líquido se mueven libremente, sin poder establecer un patrón estructural de largo alcance. Tal disposición arbitraria y dinámica puede considerarse homogénea, pero dependiendo de la molécula el líquido pudiera albergar regiones de alta o baja densidades, los cuales sí se distribuirían heterogéneamente; aun cuando dichas regiones se muevan.
Se congelan o vaporizan

Los líquidos pueden sufrir de ordinario dos cambios de fase: a la sólida (congelamiento), o a la gaseosa (vaporización). Las temperaturas a las cuales toman lugar estos cambios físicos se denominan puntos de fusión o ebullición, respectivamente.
A medida que se congelan las partículas pierden energía y quedan fijas en el espacio, orientadas ahora por sus interacciones intermoleculares. Si tal estructura resultante es periódica y ordenada, se dice que más que congelarse, ha cristalizado (como sucede con el hielo).
El congelamiento se acelera dependiendo de la velocidad con que se formen los núcleos de cristalización; es decir, cristales pequeños que crecerán hasta volverse robustos.
Mientras, en la vaporización se rompe con todo orden: las partículas adquieren energía mediante el calor y escapan a la fase gaseosa, donde viajan con mayor libertad. Este cambio de fase se acelera si se favorece el crecimiento de las burbujas en el interior del líquido, las cuales vencen la presión externa y aquella ejercida por el líquido en sí mismo.
Ejemplos de líquidos
El agua
En el planeta Tierra encontramos en gran abundancia el líquido más extraño y sorprendente de todos: el agua. Tanto es así que conforma lo que se conoce como la hidrósfera. Los océanos, mares, lagos, ríos y cascadas representan ejemplos de líquidos en su máxima expresión.
La lava

Otro líquido también conocido es la lava, ardiente al rojo vivo, la cual presenta la característica de fluir y correr cuesta abajo por los volcanes.
Petróleo
Asimismo, podemos mencionar el petróleo, mezcla líquida, compleja, negra y aceitosa compuesta en su mayoría por hidrocarburos; y el néctar de las flores, al igual que las mieles de los panales de abejas.
En la cocina
Los líquidos están presentes a la hora de cocinar. Entre ellos tenemos: el vinagre, los vinos, la salsa inglesa, el aceite, la clara de huevo, la leche, la cerveza, el café, entre otros. Y si se cocina a oscuras, la cera derretida de las velas también cuenta como ejemplo de líquido.
En los laboratorios
Todos los solventes utilizados en los laboratorios son ejemplos de líquidos: alcoholes, amoníaco, parafinas, tolueno, gasolina, tetracloruro de titanio, cloroformo, disulfuro de carbono, entre otros varios.
Los gases como el hidrógeno, helio, nitrógeno, argón, oxígeno, cloro, neón, etc., pueden condensarse en sus respectivos líquidos, los cuales se caracterizan por usarse para fines criogénicos.
Asimismo, se tiene el mercurio y el bromo, los únicos elementos líquidos en condiciones normales, y metales con puntos de fusión bajos como el galio, cesio y rubidio.
Referencias
- Química. (8va ed.). CENGAGE Learning.
- Física: para ciencias e ingeniería con Física Moderna. Volumen 2. (Séptima edición). Cengage Learning.
- Liquid. Recuperado de: en.wikipedia.org
- Liquid Definition in Chemistry. Recuperado de: thoughtco.com
