Enlace químico: qué es, definición, tipos, cómo se forman, ejemplos
¿Qué es un enlace químico?
Un enlace químico es la fuerza que mantiene unidos a los átomos de un compuesto. La fuerza que une los átomos es electromagnética, y al unirse los átomos conservan su propia naturaleza.
Por ejemplo, el agua común se forma debido a la unión de dos átomos de hidrógeno (H2) y uno de oxígeno (O); por eso su fórmula química es H2O. Aunque estén unidos para formar agua, los átomos de hidrógeno siguen siendo de hidrógeno y el de oxígeno sigue siendo oxígeno.
Recordemos que los átomos están formados por un núcleo rodeado por una nube de electrones, que tienen carga negativa. El núcleo del átomo tiene carga positiva, lo cual logra atraer a los electrones.
Sin embargo, los electrones también son atraídos por los núcleos de otros átomos. Es así cómo se forman enlaces químicos. El hecho de que los átomos cedan o compartan electrones genera los distintos tipos de enlaces químicos.
En los enlaces químicos, los átomos ceden, ganan o comparten electrones de lo que se llama capa de valencia, que es la capa más externa de un átomo donde ocurre la reactividad o la tendencia a formar enlaces químicos.
Estos enlaces hacen que se formen nuevas sustancias (no son mezclas) que no se pueden separar a través de técnicas como el tamizado o el filtrado.
Tipos de enlace químico
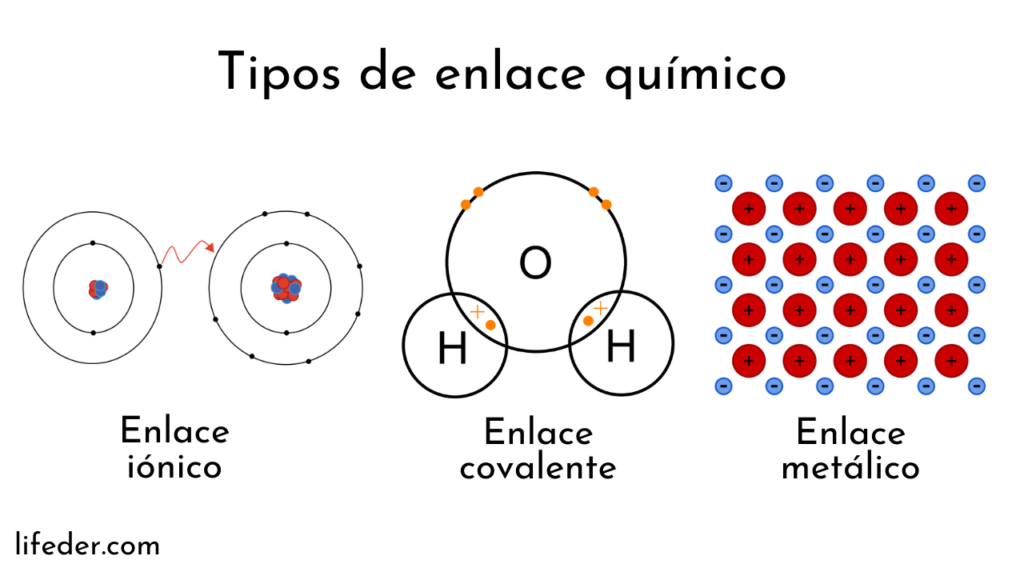
Los átomos están formados por un núcleo (con carga eléctrica positiva) y electrones (partículas con carga eléctrica negativa) que giran alrededor. Ambas partes intervienen en los enlaces químicos.
Los enlaces químicos que involucran a los núcleos atómicos se llaman metálicos. En cambio, los que implican intercambio de electrones se dividen en iónicos y covalentes.
Enlaces iónicos
Este tipo de enlace es muy resistente; produce compuestos químicos sólidos (cristales) solubles en el agua y con un elevado punto de fusión (entre 300 y 1.000 grados centígrados). Disueltos en agua, son conductores de electricidad.
¿Cómo se forman los enlaces iónicos?
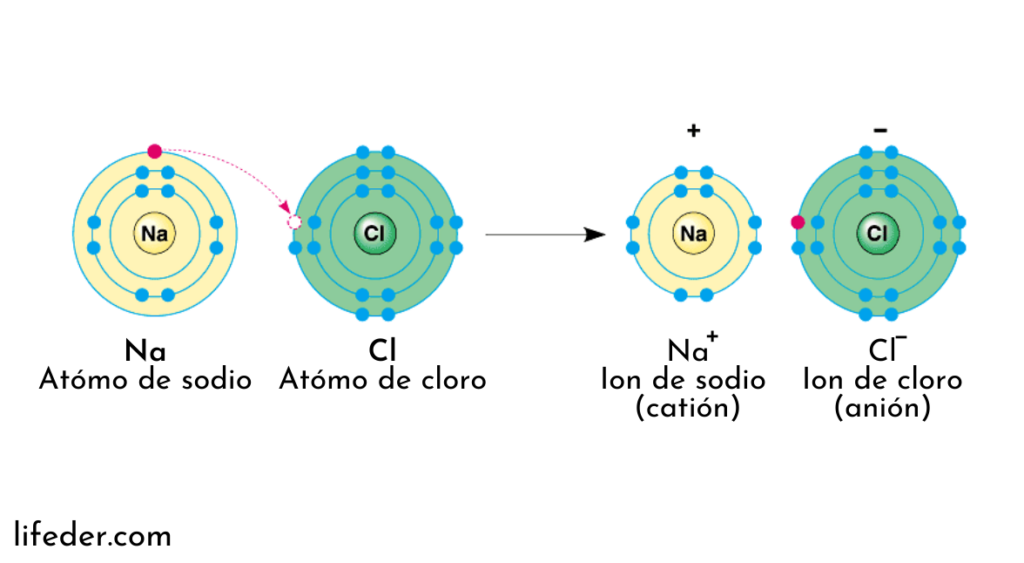
Los enlaces iónicos ocurren entre un metal y un no metal que poseen diferente electronegatividad (capacidad para atraer electrones). Los electrones de la capa de valencia de un átomo pasan a la capa de valencia del otro átomo. Lo que es lo mismo; un átomo metálico cede un electrón a un átomo no metálico, lográndose una estabilidad electrónica.
A lo largo del proceso de formación del enlace se forman iones (cationes y aniones), de ahí el nombre de enlace iónico.
Un ejemplo de este tipo de enlace es el cloruro de sodio: este compuesto químico se forma cuando el cloro (Cl) atrae el electrón de la capa de valencia que posee el átomo de sodio (Na).
Otro ejemplo es el cloruro de manganeso (MgC), que se emplea en la fabricación de pinturas y desinfectantes. Como resultado del enlace químico, los electrones del átomo de manganeso son absorbidos por el átomo de cloro.
Enlaces covalentes
Los enlaces covalentes son muy duros y generan compuestos químicos insolubles con una alta temperatura de fusión (más de 1.000 grados centígrados). No conducen electricidad.
De acuerdo con la manera en que los átomos comparten sus electrones, los enlaces covalentes pueden ser:
- Simples: comparten un par de electrones (A-A).
- Dobles: comparten dos pares de electrones (A=).
- Triples: comparten tres pares de electrones (A≡A).
¿Cómo se forman los enlaces covalentes?
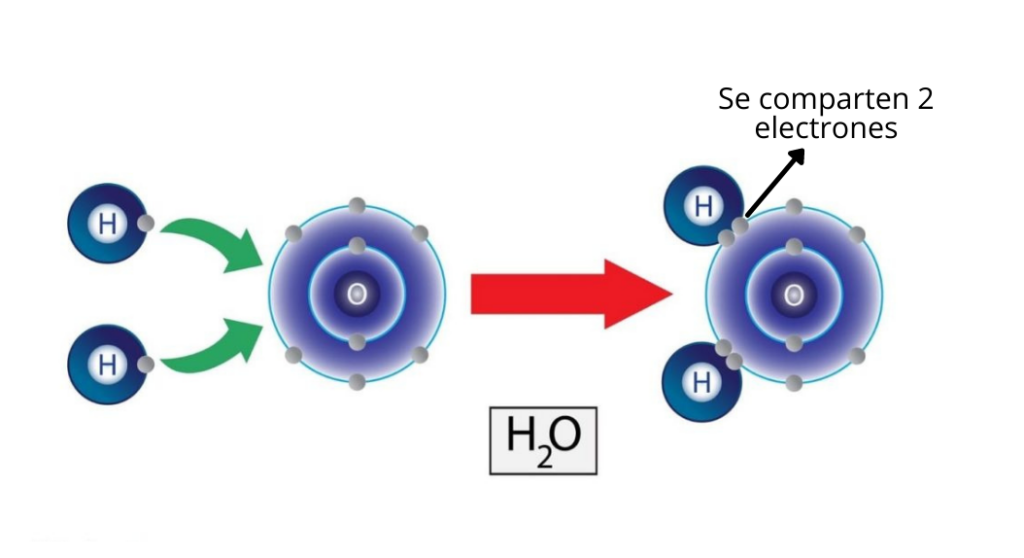
El enlace covalente se forma cuando dos elementos no metálicos comparten electrones de su capa de valencia.
El intercambio de electrones siempre se da de tal forma que cumpla con la ley del octeto. Se trata de un principio químico que afirma que la configuración más estable para un átomo es aquella en la cual este posee ocho electrones en su capa más externa.
Un ejemplo de enlace covalente es el agua (H2O). Para crear la molécula de agua se necesitan dos enlaces covalentes simples. En un enlace simple el electrón del hidrógeno se comparte con el oxígeno, y el oxígeno comparte un electrón con el hidrógeno.
Otro ejemplo de enlace covalente es el dióxido de carbono (CO2), uno de los principales responsables del efecto invernadero y del cambio climático. Para formar este compuesto el carbono y el oxígeno crean dos enlaces dobles, es decir, que por cada enlace comparten dos pares de electrones.
Enlaces metálicos
Este tipo de enlace solo sucede en elementos metálicos. Consiste en la unión de los núcleos de dos átomos del mismo elemento metálico junto con sus electrones.
Los enlaces metálicos se caracterizan por ser eficaces conductores de electricidad, tener un punto fusión y ebullición muy elevado, y oxidarse fácilmente. También son maleables y resistentes al rayado, muy sólidos y fuertes.
¿Cómo se forman los enlaces metálicos?
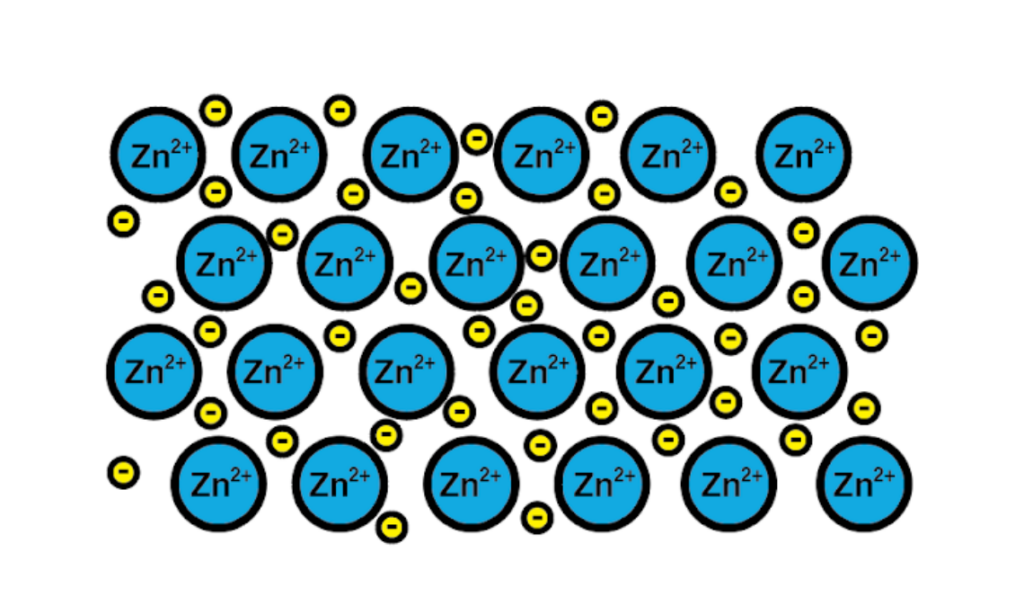
Un ejemplo de enlace metálico es el del zinc, un elemento metálico. El proceso de formación de este tipo de enlace es:
1-Un núcleo atómico de un elemento metálico se junta a otro núcleo del mismo elemento.
2-Los electrones de la capa de valencia de ambos núcleos pasan a formar un mar de electrones alrededor. Es decir, no orbitan un solo núcleo atómico.
3-Las cargas positivas de los núcleos atómicos y las negativas de los electrones se atraen. El resultado son electrones de valencia que forman el mar de electrones alrededor de los núcleos atómicos (cationes).
Ejemplos de enlace químico
Enlaces iónicos
- Óxido de bario (BaO).
- Cloruro de magnesio (MgCl2).
- Óxido de calcio (CaO)
- Nitrato de plata (AgNO3)
- Hidróxido de zinc (ZnOH2)
- Bromuro de potasio (KBr)
- Carbonato de calcio (CaCO3)
- Sulfato de cobre (CuSO4)
- Fluoruro de Litio (LiF)
- Cloruro de manganeso (MnCl2)
- Sulfato de potasio (K2SO4)
- Óxido de hierro (FeO)
- Fosfato disódico (Na2HPO4)
- Ioduro de potasio (KI)
Enlaces covalentes
- Dióxido de Carbono (CO2)
- Amoníaco (NH3)
- Parafina (CnH2n+2)
- Diesel (C12H26)
- Dibromo (Br2)
- Monóxido de Carbono (CO)
- Butano (C4H10)
- Benceno (C6H6)
- Nitrógeno molecular (N2)
- Metano (CH4)
- Ácido clorhídrico (HCl)
- Ácido cianhídrico (HCN)
Enlaces metálicos
Cualquier metal en estado puro es un ejemplo de enlace metálico, a saber:
- Níquel (Ni)
- Hierro (Fe)
- Aluminio (Al)
- Titanio (Ti)
- Plomo (Pb)
- Cobalto (Co)
- Cobre (Cu)
- Zinc (Zn)
- Mercurio (Hg)
- Oro (Au)
- Plata (Ag)
- Bario (Ba)
Importancia de los enlaces químicos
La importancia de los enlaces químicos es que forman moléculas orgánicas e inorgánicas, y de esta manera forman parte de la base de todos los organismos vivos. Si se les somete a determinadas condiciones, estos enlaces se pueden romper. Esta energía se llama energía de enlace.
Algunas de las técnicas para romper los enlaces se aplican mediante electricidad, altas temperaturas o suscitando reacciones químicas con diferentes compuestos.
Por ejemplo, para separar las moléculas de oxígeno e hidrógeno del H2O, podemos aplicar electricidad al agua, que es el proceso conocido como electrólisis.
Los compuestos químicos formados por enlace son numerosos y están presentes en la vida cotidiana. La sal que usamos para sazonar los alimentos es un compuesto químico producto del enlace entre un átomo de sodio (Na) y uno de cloro (Cl). Su fórmula química es NaCl, que se lee cloruro de sodio.
