Carbono en la naturaleza: localización, propiedades y usos
El carbono en la naturaleza puede hallarse en diamantes, petróleo y grafitos, entre muchos otros escenarios. Este elemento químico ocupa el sexto lugar en la tabla periódica y se ubica en la fila horizontal o período 2 y columna 14. Es no metálico y tetravalente; es decir, puede establecer 4 enlaces químicos de electrones compartidos o enlaces covalentes.
El carbono es el elemento con mayor abundancia en la corteza terrestre. Esta abundancia, su diversidad única en la formación de compuestos orgánicos y su capacidad excepcional de formar macromoléculas o polímeros a las temperaturas encontradas comúnmente en la Tierra, hace que sirva como elemento común de todas las formas de vida conocidas.

El carbono existe en la naturaleza como elemento químico sin combinarse en las formas de grafito y diamante. Sin embargo, en su mayor parte está combinado formando compuestos químicos de carbono, como el carbonato de calcio (CaCO3) y otros compuestos en el petróleo y el gas natural.
También forma varios minerales como la antracita, la hulla, el lignito y la turba. La mayor importancia del carbono es que constituye el llamado “bloque de construcción de la vida” y está presente en todos los organismos vivientes.
Índice del artículo
- 1 ¿Dónde se encuentra el carbono y en qué forma?
- 2 Propiedades físicas y químicas
- 3 Ciclo biogeoquímico
- 4 Usos
- 5 Referencias
Además de ser el elemento químico componente común en todas las formas de vida, el carbono en la naturaleza está presente en tres formas cristalinas: diamante, grafito y fulereno.
También existen varias formas minerales amorfas de carbón (antracita, lignito, hulla, turba), formas líquidas (variedades de petróleos) y gaseosas (gas natural).
En las formas cristalinas, los átomos de carbono se unen formando patrones ordenados con disposición espacial geométrica.
Grafito
Es un sólido blando de color negro con lustre o brillo metálico y resistente al calor (refractario). Su estructura cristalina presenta átomos de carbono unidos en anillos hexagonales que, a su vez, se unen formando láminas.
Los yacimientos de grafito son escasos y se han encontrado en China, India, Brasil, Corea del Norte y Canadá.
Diamante
Es un sólido muy duro, transparente al paso de la luz y mucho más denso que el grafito: el valor de la densidad del diamante equivale a casi el doble de la del grafito.
Los átomos de carbono en el diamante se unen en geometría tetraédrica. Así mismo, el diamante se forma a partir del grafito sometido a condiciones de muy altas temperaturas y presiones (3000 °C y 100 000 atm).
La mayor parte de los diamantes está ubicada entre 140 y 190 km de profundidad en el manto. A través de erupciones volcánicas profundas, el magma puede transportarlos a distancias cercanas a la superficie.
Existen yacimientos diamantíferos en África (Namibia, Ghana, República Democrática del Congo, Sierra Leona y Sudáfrica), América (Brasil, Colombia, Venezuela, Guyana, Perú), Oceanía (Australia) y Asia (India).

Fulerenos
Son formas moleculares de carbono que forman cúmulos de 60 y 70 átomos de carbono en moléculas casi esféricas, parecidas a balones de fútbol.
También existen fulerenos más pequeños de 20 átomos de carbono. Algunas formas de fulerenos incluyen a los nanotubos de carbono y las fibras de carbono.

En las formas amorfas los átomos de carbono no se unen constituyendo una estructura cristalina ordenada y regular. En cambio, incluso contienen impurezas de otros elementos.
Antracita
Es el carbón mineral metamórfico más antiguo (que proviene de la modificación de rocas por efectos de temperatura, presión o acción química de fluidos), pues su formación data de la era primaria o paleozoica, período carbonífero.
La antracita es la forma amorfa de carbono que presenta mayor contenido de este elemento: entre 86 y 95 %. Es de color gris-negro y brillo metálico, y es pesada y compacta.
Generalmente, la antracita se encuentra en zonas de deformación geológica y constituye aproximadamente el 1 % de las reservas mundiales de carbón.
Geográficamente se encuentra en Canadá, USA, Sudáfrica, Francia, Gran Bretaña, Alemania, Rusia, China, Australia y Colombia.

Hulla
Es un carbón mineral, roca sedimentaria de origen orgánico, cuya formación data de las eras paleozoica y mesozoica. Tiene un contenido de carbono de entre 75 y 85 %.
Es de color negro, se caracteriza por ser opaca y tener aspecto mate y graso, pues tiene alto contenido de sustancias bituminosas. Está formada por compresión del lignito en la era paleozoica, en los períodos carbonífero y pérmico.
Es la forma de carbón más abundante en el planeta. Existen grandes yacimientos de hulla en Estados Unidos, Gran Bretaña, Alemania, Rusia y China.
Lignito
Es un carbón fósil mineral formado en la era terciaria a partir de la turba por compresión (altas presiones). Posee un contenido de carbono menor que la hulla, entre 70 y 80 %.
Es un material poco compacto, desmenuzable (característica que lo distingue de los demás minerales de carbono), de color marrón o negro. Su textura es parecida a la de la madera y su contenido de carbono va de 60 a 75%.
Es un combustible fácil de encender, con poder calorífico bajo y con menor contenido de agua que la turba.
Existen importantes minas de lignito en Alemania, Rusia, República Checa, Italia (regiones del Véneto, Toscana, Umbría) y Cerdeña. En España los yacimientos de lignito están en Asturias, Andorra, Zaragoza y La Coruña.
Turba
Es un material de origen orgánico cuya formación proviene de la era cuaternaria, mucho más reciente que los carbones anteriores.
Es de color amarillo parduzco y aparece en forma de masa esponjosa de baja densidad, en la que se pueden observar restos vegetales del lugar en donde se originó.
A diferencia de los carbones citados anteriormente, la turba no proviene de procesos de carbonización de material leñoso o maderas, sino que se ha formado por acumulación de plantas —principalmente hierbas y musgos— en zonas pantanosas mediante un proceso de carbonización que no se ha completado.
La turba posee alto contenido de agua; por esta razón requiere secado y compactación antes de su uso.
Tiene un bajo contenido de carbono (solo 55 %); por tanto, tiene un bajo valor energético. Al someterse a combustión, su residuo de cenizas es abundante y emite mucho humo.
Hay yacimientos importantes de turba en Chile, Argentina (Tierra del Fuego), España (Espinosa de Cerrato, Palencia), Alemania, Dinamarca, Holanda, Rusia, Francia.

El petróleo (del latín petrae, que significa “piedra”; y oleum, que significa “aceite”: “aceite de roca”) es una mezcla de muchos compuestos orgánicos —la mayoría hidrocarburos— producidos por la descomposición bacteriana anaeróbica (en ausencia de oxígeno) de materia orgánica.
Se formó en el subsuelo, a grandes profundidades y bajo condiciones especiales tanto físicas (altas presiones y temperaturas) como químicas (presencia de compuestos catalizadores específicos) en un proceso que tardó millones de años.
Durante este proceso el C y el H se liberaron de los tejidos orgánicos y se unieron recombinándose de nuevo, para formar un inmenso número de hidrocarburos que se mezclan según sus propiedades, formando el gas natural, el petróleo y el bitumen.
Los yacimientos petrolíferos del planeta están ubicados principalmente en Venezuela, Arabia Saudita, Irak, Irán, Kuwait, Emiratos Árabes Unidos, Rusia, Libia, Nigeria y Canadá.
Existen reservas de gas natural en Rusia, Irán, Venezuela, Qatar, Estados Unidos, Arabia Saudita y Emiratos Árabes, entre otros.
Entre las propiedades del carbono podemos mencionar las siguientes:
C.
6.
Sólido, en condiciones normales de presión y temperatura (1 atmósfera y 25 °C).
Gris (grafito) y transparente (diamante).
12,011 g/mol.
500 °C.
827 °C.
2,62 g/cm3.
Insoluble en agua, soluble en tetracloruro de carbono CCl4.
1s2 2s2 2p2.
4.
4.
Tiene la capacidad de formar compuestos químicos en largas cadenas.
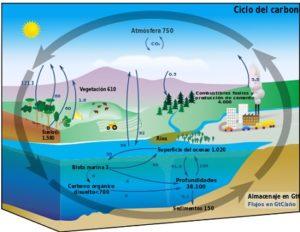
El ciclo del carbono es un proceso circular biogeoquímico a través del cual el carbono puede intercambiarse entre la biosfera, la atmósfera, la hidrósfera y la litósfera terrestres.
El conocimiento de este proceso cíclico del carbono en la Tierra permite evidenciar la acción humana sobre este ciclo y sus consecuencias sobre el cambio climático global.
El carbono puede circular entre los océanos y demás cuerpos de agua, así como entre la litósfera, en suelo y subsuelo, en la atmósfera y en la biosfera. En la atmósfera y la hidrósfera, el carbono existe en forma gaseosa como CO2 (dióxido de carbono).
El carbono de la atmósfera es captado por los organismos productores terrestres y acuáticos de los ecosistemas (organismos fotosintéticos).
La fotosíntesis permite que ocurra una reacción química entre el CO2 y el agua, mediada por la energía solar y la clorofila de las plantas, para producir carbohidratos o azúcares. Este proceso transforma moléculas sencillas de bajo contenido energético de CO2, H2O y oxígeno O2, en formas moleculares complejas de alta energía, que son los azúcares.
Los organismos heterótrofos —que no pueden realizar la fotosíntesis y que son los consumidores en los ecosistemas— obtienen carbono y energía al alimentarse de los productores y de otros consumidores.
La respiración y la descomposición son procesos biológicos que liberan carbono al ambiente en forma de CO2 o CH4 (metano producido en la descomposición anaerobia; es decir, en ausencia de oxígeno).
Mediante procesos geológicos y como consecuencia del transcurso del tiempo, el carbono de la descomposición anaeróbica puede transformarse en combustibles fósil como el petróleo, el gas natural y el carbón. Así mismo, el carbono también forma parte de otros minerales y rocas.
Cuando el hombre utiliza la quema de combustibles fósiles para obtener energía, el carbono retorna a la atmósfera en forma de inmensas cantidades de CO2 que no pueden ser asimiladas por el ciclo biogeoquímico natural del carbono.
Este exceso de CO2 producido por la actividad humana impacta negativamente en el equilibrio del ciclo del carbono y es la causa principal del calentamiento del planeta.
Los usos del carbono y sus compuestos son extremadamente variados. Los más destacados con los siguientes:
El uso económico principal del carbono está representado en su utilización como hidrocarburo combustible fósil, como el gas metano y el petróleo.
El petróleo se destila en refinerías para obtener múltiples derivados como gasolina, diésel, kerosén, asfalto, lubricantes, solventes y otros, que a su vez se emplean en la industria petroquímica productora de materias primas para las industrias de plásticos, fertilizantes, fármacos y pinturas, entre otras.
El grafito se emplea en las siguientes acciones:
– Se usa en la fabricación de lápices, mezclado con arcillas.
– Forma parte de la elaboración de ladrillos y crisoles refractarios, resistentes al calor.
– En varios dispositivos mecánicos como arandelas, rodamientos, pistones y juntas.
– Es un excelente lubricante sólido.
– Por su conductividad eléctrica y su inercia química, se emplea en la fabricación de electrodos, carbones de motores eléctricos.
– Se usa como moderador en centrales nucleares.
El diamante tiene propiedades físicas particularmente excepcionales, como el mayor grado de dureza y conductividad térmica conocidos hasta ahora.
Estas características permiten aplicaciones industriales en herramientas usadas para efectuar cortes e instrumentos para pulido por su alta abrasividad.
Sus propiedades ópticas —como la transparencia y la capacidad de descomponer la luz blanca y refractar la luz— le confieren muchas aplicaciones en instrumentos ópticos, como en la fabricación de lentes y prismas.
El brillo característico derivado de sus propiedades ópticas también es muy apreciado en la industria de la joyería.
La antracita presenta dificultad para encender, es de combustión lenta y de mucho requerimiento de oxígeno. Su combustión produce poca llama de color azul pálido y emisión de mucho calor.
Hace algunos años, la antracita se utilizaba en las centrales termoeléctricas y para calefacción doméstica. Su uso presenta ventajas como la producción de poca ceniza o polvo, poco humo y un proceso lento de combustión.
Por su costo económico elevado y su escasez, la antracita ha sido sustituida por el gas natural en centrales termoeléctricas y por la energía eléctrica en hogares.
La hulla se emplea como materia prima para obtener:
– Coque, combustible de los altos hornos en las acerías.
– Creosota, obtenida al mezclar los destilados del alquitrán proveniente de la hulla y empleada como sellador protector de maderas expuestas a la intemperie.
– Cresol (químicamente metilfenol) extraído de la hulla y utilizado como desinfectante y antiséptico,
– Otros derivados como gas, alquitrán o brea, y compuestos empleados en fabricación de perfumes, insecticidas, plásticos, pinturas, neumáticos y pavimentos de carreteras, entre otros.
El lignito representa un combustible de mediana calidad. El azabache, variedad de lignito, se caracteriza por ser muy compacto por el largo proceso de carbonización y altas presiones, y se emplea en joyería y ornamentación.
La turba se usa en las siguientes actividades;
– Para el crecimiento, sostén y transporte de especies vegetales.
– Como abono orgánico.
– Como lecho de animales en establos.
– Como combustible de baja calidad.
- Burrows, A., Holman, J., Parsons, A., Pilling, G. and Price, G. (2017). Chemistry3: Introducing Inorganic, Organic and Physical Chemistry. Oxford University Press.
- Deming, A. (2010). King of the elements? Nanotechnology. 21 (30): 300201. doi:10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. and Zandbergen, H. (2004). Superlubricity of Graphite. Physical Review Letters. 92 (12): 126101. doi:10.1103
- Irifune, T., Kurio,A., Sakamoto, S., Inoue, T. and Sumiya, H. (2003). Materials: Ultrahard polycrystalline diamond from graphite. Nature. 421 (6923): 599–600. doi:10.1038
- Savvatimskiy, A. (2005). Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003). Carbon. 43 (6): 1115. doi:10.1016
