Tabla periódica de los elementos: qué es, estructura, elementos, descarga
¿Qué es la tabla periódica?
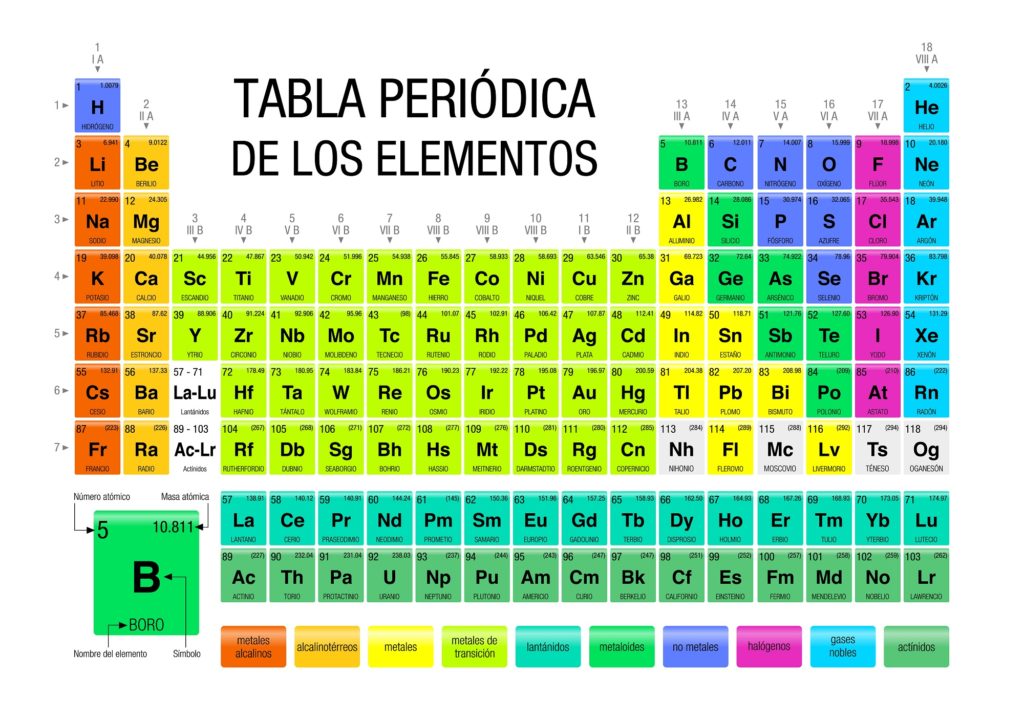
La tabla periódica de los elementos es una herramienta que permite consultar las propiedades químicas de los 118 elementos conocidos hasta ahora. Es indispensable al momento de realizar cálculos estequiométricos, predecir las propiedades físicas de un elemento, clasificarlos, y encontrar propiedades periódicas entre todos ellos.
Los átomos se vuelven más pesados a medida que sus núcleos adicionan protones y neutrones, los cuales deben también estar acompañados de nuevos electrones; de lo contrario, no sería posible la electroneutralidad. Así, algunos átomos son muy livianos, como el hidrógeno, y otros, superpesados, como el oganesón.
¿A quién se le debe tal corazón en la química? Al científico Dmitri Mendeléyev, quien en 1869 (hace casi 150 años) publicó, tras una década de estudios teóricos y experimentos, la primera tabla periódica en un intento de organizar los 62 elementos conocidos por aquel entonces.
Para ello, Mendeléyev se basó en las propiedades químicas, mientras que paralelamente Lothar Meyer publicó otra tabla periódica que estaba organizada de acuerdo a las propiedades físicas de los elementos.
Inicialmente, la tabla contenía “espacios vacíos”, cuyos elementos no habían sido conocidos por aquellos años. Sin embargo, Mendeléyev fue capaz de predecir con apreciable exactitud varias de sus propiedades. Algunos de estos elementos fueron: germanio (al cual llamó eka-silicio) y galio (eka-aluminio).
Las primeras tablas periódicas ordenaban los elementos en función de sus masas atómicas. Este ordenamiento dejaba entrever alguna periodicidad (repetición y semejanza) en las propiedades químicas de los elementos; no obstante, los elementos de transición no concordaban con este orden, y tampoco los gases nobles.
Por esta razón, fue necesario ordenar los elementos considerando el número atómico (número de protones), en lugar de la masa atómica. De aquí, junto al arduo trabajo y contribuciones de muchos autores, se perfeccionó y completó la tabla periódica de Mendeléyev.
¿Cómo está organizada la tabla periódica? (Estructura y organización)
Puede observarse que el pastel de la tabla periódica posee varios colores. Cada color asocia elementos con propiedades químicas similares. Hay columnas anaranjadas, amarillas, azules, moradas; casillas verdes, y una diagonal de color verde manzana.
Nótese que las casillas de las columnas del medio son de color grisáceos, por lo que todos esos elementos deben tener algo en común, y es que son metales de transición con orbitales d semillenos.
Del mismo modo, los elementos de las casillas moradas, aunque pasan de sustancias gaseosas, de un líquido rojizo y hasta sólidos negro morado (el yodo) y plateado grisáceo (astato), son sus propiedades químicas las que los hacen congéneres. Estas propiedades están regidas por las estructuras electrónicas de sus átomos.
La organización y estructura de la tabla periódica no es arbitraria, sino que obedece una serie de propiedades periódicas y patrones de valores determinados para los elementos. Por ejemplo, si el carácter metálico disminuye de izquierda a derecha de la tabla, no puede esperarse un elemento metálico en la esquina superior derecha.
Períodos
Los elementos se ordenan en filas o períodos dependiendo del nivel energético de sus orbitales. Antes del período 4, cuando los elementos se sucedían en orden creciente de la masa atómica, se encontraba que por cada ocho de ellos las propiedades químicas volvían a repetirse (ley de las octavas, de John Newlands).
Los metales de transición se colaban con otros elementos no metálicos, como el azufre y el fósforo. Por esta razón, fue vital la entrada de la física cuántica y el de las configuraciones electrónicas para el entendimiento de las tablas periódicas modernas.
Los orbitales de una capa energética se van llenando de electrones (y los núcleos de protones y neutrones), a medida que se desplaza a lo largo de un período. Esta capa energética va de la mano con el tamaño o radio atómico; por lo tanto, los elementos de los períodos superiores son más pequeños que aquellos que se encuentran abajo.
El H y el He se encuentran en el primer (período) nivel energético; la primera fila de casillas grisáceas, en el cuarto período; y la fila de casillas anaranjadas, en el sexto período. Nótese que, aunque esta última aparenta estar en el supuesto noveno período, en realidad pertenece al sexto, justo después de la casilla amarilla de Ba.
Grupos
Recorriendo un período se encuentra que la masa, el número de protones y de electrones aumentan. En una misma columna o grupo, aunque varíen la masa y los protones, el número de electrones de la capa de valencia es el mismo.
Por ejemplo, en la primera columna o grupo, el H tiene un solo electrón en el orbital 1s1, al igual que el Li (2s1), el sodio (3s1), el potasio (4s1) y así hasta el francio (7s1). Ese número 1 denota que estos elementos apenas poseen un electrón valencia, y por lo tanto, pertenecen al grupo 1 (IA). Cada elemento está en períodos diferentes.
Sin contar al hidrógeno, de casilla verde, los elementos debajo de él son de casillas anaranjadas y se les llaman metales alcalinos. Una casilla más a la derecha en cualquier período, se encuentra el grupo o la columna 2; es decir, sus elementos tienen dos electrones de valencia.
Pero al moverse un paso más a la derecha, sin los conocimientos de los orbitales d, se llega al grupo del boro (B) o grupo 13 (IIIA); en lugar del grupo 3 (IIIB) o del escandio (Sc). Tomando en consideración el llenado de los orbitales d, se empieza a recorrer los períodos de las casillas grisáceas: los metales de transición.
Números de protones vs electrones de valencia
Al estudiar la tabla periódica puede surgir una confusión entre el número atómico Z o número de protones totales en el núcleo, y la cantidad de electrones de valencia. Por ejemplo, el carbono tiene un Z=6, es decir, tiene seis protones y por lo tanto seis electrones (de lo contrario no podría ser un átomo con carga neutra).
Pero, de esos seis electrones, cuatro son de valencia. Por esa razón su configuración electrónica es [He]2s22p2. [He] denota los dos electrones 1s2 de la capa cerrada, y teóricamente no participan en la formación de enlaces químicos.
Asimismo, debido a que el carbono tiene cuatro electrones de valencia, “convenientemente” se ubica en el grupo 14 (IVA) de la tabla periódica.
Los elementos por debajo del carbono (Si, Ge, Sn, Pb y Fl) poseen números atómicos (y masas atómicas) más superiores; pero todos tienen en común los cuatro electrones de valencia. Esto es clave para el entendimiento de por qué un elemento pertenece a un grupo y no a otro.
Elementos de la tabla periódica
Bloque s
Como acaba de explicarse, los grupos 1 y 2 se caracterizan por tener uno o dos electrones en orbitales s. Estos orbitales son de geometría esférica, y a medida que se desciende por cualquiera de estos grupos, los elementos van adquiriendo capas las cuales incrementan el tamaño de sus átomos.
Por presentar fuertes tendencias en sus propiedades químicas y modos de reaccionar, a estos elementos se les organiza como el bloque s. Por lo tanto, los metales alcalinos y los metales alcalinotérreos pertenecen a este bloque. La configuración electrónica de los elementos de este bloque es ns (1s, 2s, etc.).
Aunque el elemento helio esté en el extremo superior derecho de la tabla, su configuración electrónica es 1s2 y pertenece por tanto a este bloque.
Bloque p
A diferencia del bloque s, los elementos de este bloque presentan orbitales s completamente llenos, mientras que sus orbitales p continúan llenándose con electrones. Las configuraciones electrónicas de los elementos pertenecientes a este bloque son del tipo ns2np1-6 (los orbitales p pueden tener uno o hasta seis electrones para llenarse).
Entonces, ¿en qué parte de la tabla periódica se encuentra este bloque? A la derecha: las casillas verdes, moradas y azules; es decir, los elementos no metálicos y los metales pesados, como el bismuto (Bi) y el plomo (Pb).
Empezando por el boro, con configuración electrónica ns2np1, el carbono a su derecha adiciona otro electrón: 2s22p2. Seguidamente, las configuraciones electrónicas de los demás elementos del período 2 del bloque p son: 2s22p3 (nitrógeno), 2s22p4 (oxígeno), 2s22p5 (flúor) y 2s22p6 (neón).
Si se baja a los períodos inferiores, se tendrá el nivel energético 3: 3s23p1-6, y así sucesivamente hasta el final del bloque p.
Nótese que lo más importante de este bloque es que, a partir del período 4, sus elementos tienen los orbitales d completamente llenos (casillas azules en adelante a la derecha). En resumen: el bloque s está a la izquierda de la tabla periódica, y el bloque p, a la derecha.
Elementos representativos
¿Cuáles son los elementos representativos? Son aquellos que por un lado pierde fácilmente electrones, o por el otro, los ganan para completar el octeto de valencia. En otras palabras: son los elementos de los bloques s y p.
Sus grupos se distinguían de los demás mediante una letra A al final. Así, había ocho grupos: del IA al VIIIA. Pero actualmente, el sistema de numeración utilizado en las tablas periódicas modernas es el arábico, del 1 al 18, incluyendo los metales de transición.
Por esa razón el grupo del boro puede ser el IIIA, o 13 (3+10); el grupo del carbono, IVA o 14; y el de los gases nobles, el último a la derecha de la tabla, VIIIA o 18.
Metales de transición
Los metales de transición son todos los elementos de las casillas grisáceas. A lo largo de sus períodos, se van llenando sus orbitales d, los cuales son cinco y pueden por lo tanto tener diez electrones. Como deben tener diez electrones para llenar dichos orbitales, entonces debe haber diez grupos o columnas.
A cada uno de estos grupos en el viejo sistema de numeración se le designaba con números romanos y una letra B al final. El primer grupo, el del escandio, era el IIIB (3), el del hierro, cobalto y níquel VIIIB por tener reactividades muy parecidas (8, 9 y 10), y el de zinc IIB (12).
Como puede apreciarse, es mucho más sencillo reconocer los grupos por números arábicos que utilizando los números romanos.
Metales de transición interna
A partir del período 6 de la tabla periódica, los orbitales f empiezan a estar energéticamente disponibles. Estos deben llenarse primero que los orbitales d; y por lo tanto, sus elementos usualmente se colocan aparte para no alargar demasiado la tabla.
Los dos últimos períodos, el anaranjado y el grisáceo, son los metales de transición interna, también llamados lantánidos (tierras raras) y actínidos. Son siete orbitales f, los cuales necesitan catorce electrones para llenar, y por lo tanto, debe haber catorce grupos.
Si se suman estos grupos a la tabla periódica, habrá 32 en total (18 + 14) y se tendrá una versión “alargada”:
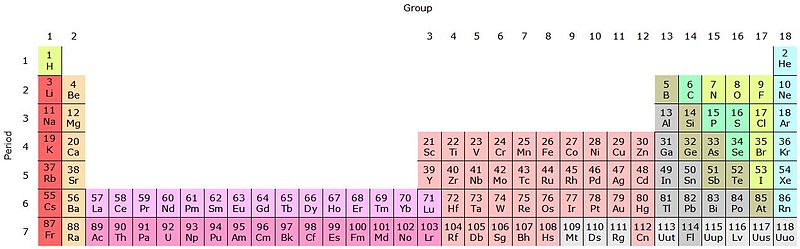
La fila rosado claro corresponde a los lantanoides, mientras que la fila rosado oscuro los actinoides. El lantano, La con Z=57, el actinio, Ac con Z=89, y todo el bloque f pertenecen al mismo grupo del escandio. ¿Por qué? Porque el escandio tiene un orbital nd1, el cual está presente en el resto de los lantanoides y actinoides.
El La y el Ac tienen configuraciones de valencia 5d16s2 y 6d17s2. Conforme se desplaza a la derecha por ambas filas, los orbitales 4f y 5f empiezan a llenarse. Una vez llenos, se llega a los elementos lutecio, Lu, y laurencio, Lr.
Metales y no metales
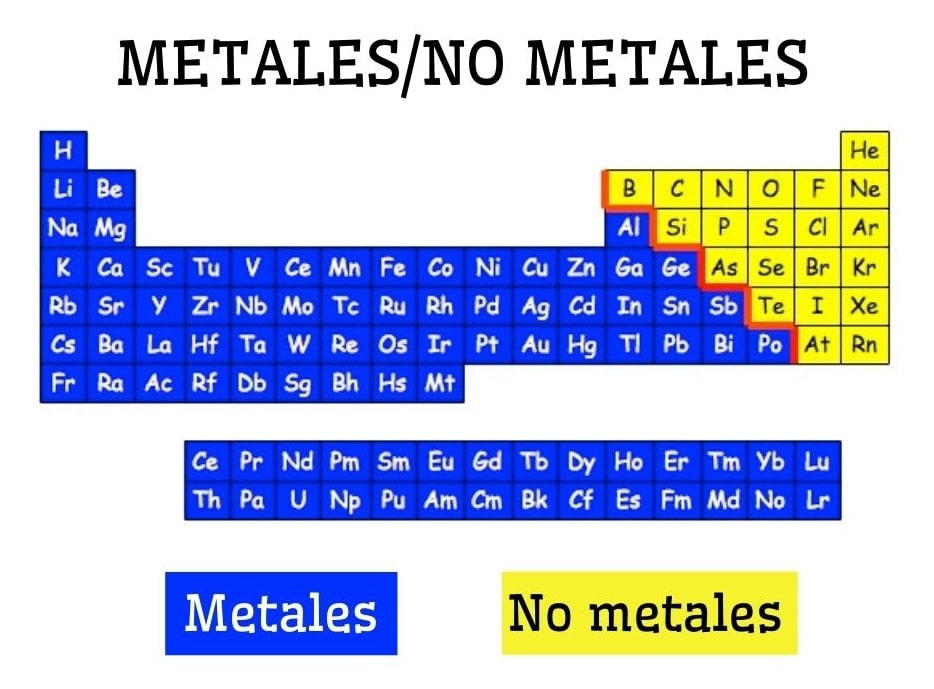
Dejando atrás el pastel de la tabla periódica, resulta más conveniente recurrir a la de la imagen superior, aun en su forma alargada. Por el momento la gran mayoría de los elementos mencionados han sido metales.
A temperatura ambiente, todos los metales son sustancias sólidas (excepto el mercurio, que es líquido) de color grisáceo plateado (a excepción del cobre y del oro). Asimismo, suelen ser duros y brillantes; aunque los del bloque s son blandos y frágiles. Estos elementos se caracterizan por su facilidad de perder electrones y formar cationes M+.
En el caso de los lantanoides, pierden los tres electrones 5d16s2 para convertirse en cationes trivalentes M3+ (como el La3+). El cerio, por su parte, es capaz de perder cuatro electrones (Ce4+).
Por otro lado, los elementos no metálicos componen la menor parte de la tabla periódica. Son gases o sólidos con átomos enlazados covalentemente (como el azufre y el fósforo). Todos se ubican en el bloque p; más precisamente, en la parte alta de éste, pues descendiendo a los períodos inferiores aumenta el carácter metálico (Bi, Pb, Po).
Además, los no metales en lugar de perder electrones, los gana. Así, forman aniones X– con diferentes cargas negativas: -1 para los halógenos (grupo 17), y -2 para los calcógenos (grupo 16, el del oxígeno).
Familias metálicas
Dentro de los metales existe una clasificación interna para diferenciarlos entre sí:
- Los metales del grupo 1 son los alcalinos.
- Grupo 2, metales alcalinotérreos (Sr. Becambara).
- Grupo 3 (IIIB) familia del escandio. Esta familia está conformada por el escandio, cabezal del grupo, del itrio Y, del lantano, actinio, y todos los lantanoides y actinoides.
- Grupo 4 (IVB), familia del titanio: Ti, Zr (circonio), Hf (hafnio) y Rf (rutherfordio). ¿Cuántos electrones de valencia tienen? La respuesta está en su grupo.
- Grupo 5 (VB), familia del vanadio. Grupo 6 (VIB), familia del cromo. Y así sucesivamente hasta la familia del zinc, grupo 12 (IIB).
Metaloides
El carácter metálico aumenta de derecha a izquierda, y de arriba hacia abajo. Pero, ¿cuál es la frontera entre estos dos tipos de elementos químicos? Dicha frontera está compuesta por elementos conocidos como metaloides, los cuales poseen características tanto de metales como de no metales.
Los metaloides pueden apreciarse en la tabla periódica en la “escalera” que empieza con el boro, y termina en el elemento radiactivo astato. Estos elementos son:
- B: boro.
- Silicio: Si.
- Ge: germanio.
- As: arsénico.
- Sb: antimonio.
- Te: telurio.
- At: astato.
Cada uno de estos siete elementos exhibe propiedades intermedias, las cuales varían de acuerdo al entorno químico o la temperatura. Una de estas propiedades es la semiconducción, es decir, los metaloides son semiconductores.
Gases
En las condiciones terrestres, los elementos gaseosos son aquellos no metales livianos, como el nitrógeno, oxígeno y el flúor. Asimismo, el cloro, el hidrógeno y los gases nobles entran en esta clasificación. De todos ellos, los más emblemáticos son los gases nobles, por su baja tendencia a reaccionar y comportarse como átomos libres.
Estos últimos se encuentra en el grupo 18 de la tabla periódica y son:
- Helio, He.
- Neón, Ne.
- Argón, Ar.
- Kriptón, Kr.
- Xenón, Xe.
- Radón, Rn.
- Y el más reciente de todos, el gas noble sintético oganesón, Og.
Todos los gases nobles tienen en común la configuración de valencia ns2np6; es decir, tienen completo el octeto de valencia.
Estados de agregación de los elementos a otras temperaturas
Los elementos están en estado sólido, líquido o gaseoso dependiendo de la temperatura y la fuerza de sus interacciones. Si la temperatura de la Tierra se enfriara hasta rondar el cero absoluto (0K), entonces todos los elementos se congelarían; a excepción, del helio, el cual condensaría.
A esta temperatura extrema, el resto de los gases se encontrarían en forma de hielo.
En el otro extremo, si la temperatura fuera de 6000K aproximadamente, “todos” los elementos se encontrarían en estado gaseoso. En estas condiciones, literalmente podrían observarse nubes de oro, de plata, de plomo y otros metales.
Usos y aplicaciones
La tabla periódica por sí sola siempre ha sido y será, una herramienta de consulta de los símbolos, masas atómicas, estructuras y otras propiedades de los elementos. Es de enorme utilidad a la hora de realizar cálculos estequiométricos, los cuales están a la orden del día en muchas labores dentro y fuera del laboratorio.
No sólo eso, sino que además la tabla periódica permite comparar los elementos de un mismo grupo o período. Así, se puede predecir cómo serán ciertos compuestos de los elementos.
Predicción de las fórmulas de los óxidos
Por ejemplo, para los óxidos de los metales alcalinos, por tener un solo electrón de valencia, y por lo tanto una valencia de +1, se espera que la fórmula de sus óxidos sea del tipo M2O. Esto se comprueba con el óxido de hidrógeno, el agua, H2O. También con los óxidos de sodio, Na2O, y de potasio, K2O.
Para los demás grupos, sus óxidos deben tener fórmula general M2On, donde n es igual al número de grupo (si el elemento es del bloque p, se calcula n-10). Así, el carbono, que pertenece al grupo 14, forma CO2 (C2O4/2); el azufre, del grupo 16, SO3 (S2O6/2); y el nitrógeno, del grupo 15, N2O5.
No obstante, esto no aplica para los metales de transición. Esto se debe a que, el hierro, aunque pertenezca al grupo 8, no puede perder 8 electrones sino 2 o 3. Por lo tanto, en lugar de memorizar las fórmulas, es más importante atender a las valencias de cada elemento.
Valencias de los elementos
Las tablas periódicas (algunas) muestran las valencias posibles para cada elemento. Conociendo estas, se puede estimar por adelantado la nomenclatura de un compuesto y su fórmula química. Las valencias, como se mencionó anteriormente, se relacionan con el número de grupo; aunque no aplica para todos los grupos.
Las valencias dependen más de la estructura electrónica de los átomos, y de cuáles electrones realmente pueden perder o ganar.
Al conocer el número de electrones de valencia, se puede igualmente iniciar con la estructura de Lewis de un compuesto a partir de esta información. La tabla periódica por lo tanto, permite a estudiantes y profesionales bosquejar estructuras y dar paso a un sondeo de las posibles geometrías y estructuras moleculares.
Tablas periódicas digitales
Hoy en día la tecnología ha permitido que las tablas periódicas sean más versátiles y aporten mayor información al alcance de todo el mundo. Varias de ellas traen ilustraciones llamativas de cada elemento, además de un breve resumen de sus principales usos.
El modo en que se interactúa con ellas agiliza su comprensión y estudio. La tabla periódica debe ser una herramienta que resulte agradable a la vista, de fácil exploración, y el método más efectivo para conocer sus elementos químicos es recorrerla de períodos a grupos.
Importancia de la tabla periódica
Actualmente, la tabla periódica es el instrumento de organización más importante de la química debido a las detalladas relaciones de sus elementos. Su uso es imprescindible tanto para estudiantes y docentes como para investigadores y muchos profesionales dedicados a la rama de la química e ingeniería.
Con tan solo mirar la tabla periódica, se obtiene una cantidad e información inmensa de manera rápida y eficaz, como por ejemplo:
- El litio (Li), el berilio (Be) y el boro (B) conducen la electricidad.
- El litio es un metal alcalino, el berilio es un metal alcalinotérreo y el boro es no metal.
- El litio es el mejor conductor de los tres nombrados, seguido por el berilio y, por último, el boro (semiconductor).
Así, mediante la ubicación de estos elementos en la tabla periódica se puede concluir instantáneamente su tendencia a la conductividad eléctrica.
Otras tablas periódicas
- Tabla periódica en español.
- Tabla periódica con solo elementos.
- Tabla periódica en blanco.




