Fosforilación oxidativa: etapas, funciones e inhibidores
La fosforilación oxidativa es un proceso donde se sintetizan moléculas de ATP a partir de ADP y Pi (fosfato inorgánico). Este mecanismo es realizado por bacterias y células eucariotas. En las células eucariotas, la fosforilación se lleva a cabo en la matriz mitocondrial de células no fotosintéticas.
La producción de ATP está dirigida por la transferencia de electrones desde las coenzimas NADH o FADH2 al O2. Este proceso representa la mayor producción de energía en la célula y se deriva de la degradación de hidratos de carbono y las grasas.
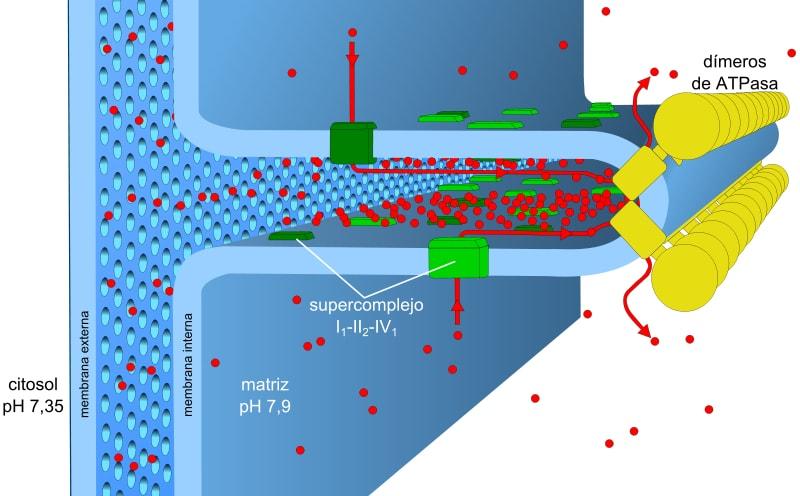
La energía almacenada en los gradientes de carga y pH, también conocida como fuerza motriz protónica, permite que se lleve a cabo dicho proceso. El gradiente de protones que se genera, ocasiona que la parte externa de la membrana tenga una carga positiva por la concentración de protones (H+) y la matriz mitocondrial sea negativa.
Índice del artículo
- 1 ¿Dónde ocurre la fosforilación oxidativa?
- 2 Etapas
- 3 Productos
- 4 Funciones
- 5 Control de la fosforilación oxidativa
- 6 Referencias
Los procesos de transporte de electrones y fosforilación oxidativa están asociados a una membrana. En los procariotas estos mecanismos se llevan a cabo a través de la membrana plasmática. En células eucariotas se asocian a la membrana de la mitocondria.
El número de mitocondrias que se encuentran en las células varía según el tipo de célula. Por ejemplo, en mamíferos los eritrocitos carecen de estas organelas, mientras que otros tipos celulares, como las células musculares, pueden tener hasta millones de ellas.
La membrana mitocondrial consta de una membrana externa simple, una membrana interna algo más compleja, y en medio de ellas el espacio intermembranal, donde se localizan muchas enzimas dependientes de ATP.
La membrana externa contiene una proteína llamada porina que forma los canales para la difusión simple de moléculas pequeñas. Esta membrana se encarga de mantener la estructura y forma de la mitocondria.
La membrana interna posee mayor densidad y es rica en proteínas. Además es impermeable para moléculas e iones por lo que, para atravesarla, necesitan de proteínas intermembranales que las transporten.
Dentro de la matriz, se extienden pliegues de la membrana interna, formando crestas que le permiten tener gran área en un volumen pequeño.
La mitocondria se considera como la central productora de energía celular. En ella se encuentran las enzimas que intervienen en los procesos del ciclo del ácido cítrico, oxidación de ácidos grasos y las enzimas y proteínas redox del transporte de electrones y la fosforilación del ADP.
El gradiente de concentración de los protones (gradiente de pH) y el gradiente de cargas o potencial eléctrico en la membrana interna de la mitocondria, son los causantes de la fuerza motriz protónica. La poca permeabilidad de la membrana interna para iones (distintos al H+) permite a la mitocondria tener un gradiente estable de voltaje.
El transporte electrónico, bombeo de protones y la obtención de ATP ocurren de forma simultánea en la mitocondria, gracias a la fuerza motriz protónica. El gradiente de pH mantiene condiciones ácidas en la intermembrana y a la matriz mitocondrial con condiciones alcalinas.
Por cada dos electrones transferidos al O2 unos 10 protones son bombeados por la membrana, creando un gradiente electroquímico. La energía desprendida en este proceso se produce de forma gradual mediante el paso de los electrones a través de la cadena transportadora.
La energía liberada durante las reacciones de óxido-reducción del NADH y FADH2 es considerablemente alta (alrededor de 53 kcal/mol por cada par de electrones), por lo que para ser usada en la fabricación de moléculas de ATP, debe producirse gradualmente con el paso de los electrones a través de transportadores.
Estos se organizan en cuatro complejos ubicados en la membrana mitocondrial interna. El acoplamiento de estas reacciones a la síntesis del ATP se lleva a cabo en un quinto complejo.
El NADH transfiere un par de electrones que entran en el complejo I de la cadena transportadora de electrones. Los electrones son transferidos al mononucleótido de flavina, y luego a la ubiquinona (coenzima Q) a través de un transportador hierro-azufre. Este proceso libera una cuantiosa cantidad de energía (16,6 kcal/mol).
La ubiquinona transporta a los electrones a través de la membrana hasta el complejo III. En este complejo los electrones pasan por los citocromos b y c1 gracias a un transportador hierro-azufre.
Del complejo III pasan los electrones al complejo IV (citocromo c oxidasa), trasladados uno por uno en el citocromo c (proteína periférica de membrana). En el complejo IV los electrones pasan por un par de iones de cobre (Cua2+), seguidamente al citocromo ca, luego a otro par de iones de cobre (Cub2+) y de este al citocromo a3.
Finalmente, los electrones se transfieren al O2 que es el último aceptor y forma una molécula de agua (H2O) por cada par de electrones recibidos. El paso de los electrones desde el complejo IV al O2 genera también gran cantidad de energía libre (25,8 kcal/mol).
El complejo II (succinato CoQ reductasa) recibe un par de electrones del ciclo del ácido cítrico, por la oxidación de una molécula de succinato a fumarato. Estos electrones se transfieren al FAD, pasando luego por un grupo hierro-azufre, hasta la ubiquinona. Desde esta coenzima pasan al complejo III y siguen la ruta descrita previamente.
La energía liberada en la reacción de traspaso de electrones hasta el FAD no es suficiente para impulsar los protones a través de la membrana, por lo que en este paso de la cadena no se genera fuerza motriz protónica, y consecuentemente el FADH rinde menos H+ que el NADH.
La energía generada en el proceso de transporte de electrones descrito previamente, debe poder usarse para la producción de ATP, reacción catalizada por la enzima ATP sintasa o complejo V. La conservación de dicha energía se conoce como acoplamiento de energía, y el mecanismo ha sido difícil de caracterizar.
Se han descrito varias hipótesis para describir esta transducción energética. La mejor aceptada es la hipótesis de acoplamiento quimiosmótico, descrita a continuación.
Este mecanismo propone que la energía utilizada para la síntesis de ATP proviene de un gradiente protónico en membranas celulares. Este proceso interviene en las mitocondrias, cloroplastos y bacterias y está vinculado al transporte de electrones.
Los complejos I y IV del transporte electrónico actúan como bombas protónicas. Estos sufren cambios conformacionales que les permite bombear los protones hacia el espacio intermembranal. En el complejo IV por cada par de electrones se bombean al exterior de la membrana dos protones y dos más quedan en la matriz formando H2O.
La ubiquinona en el complejo III acepta protones de los complejos I y II y los libera en el exterior de la membrana. Los complejos I y III permiten cada uno el paso de cuatro protones por cada par de electrones transportados.
La matriz mitocondrial tiene baja concentración de protones y potencial eléctrico negativo mientras que el espacio intermembranal presenta las condiciones inversas. El flujo de protones a través de esta membrana supone el gradiente electroquímico que almacena la energía necesaria (± 5 kcal/mol por protón) para la síntesis de ATP.
La enzima ATP sintetasa es el quinto complejo involucrado en la fosforilación oxidativa. Se encarga de aprovechar la energía del gradiente electroquímico para formar ATP.
Esta proteína transmembranal consta de dos componentes: F0 y F1. El componente F0 permite el retorno de los protones hacia la matriz mitocondrial funcionando como canal y el F1 cataliza la síntesis del ATP mediante ADP y Pi, utilizando la energía de dicho retorno.
El proceso de síntesis de ATP requiere un cambio estructural en F1 y el ensamblaje de los componentes F0 y F1. La translocación de protones a través de F0 causa cambios conformacionales en tres subunidades del F1, permitiendo que este actúe como un motor de rotación, dirigiendo la formación del ATP.
La subunidad que se encarga de la unión de ADP con Pi pasa de un estado débil (L) a uno activo (T). Al formarse el ATP, una segunda subunidad pasa a un estado abierto (O) que permite la liberación de esta molécula. Tras ser liberado el ATP, esta subunidad pasa del estado abierto a un estado inactivo (L).
Las moléculas de ADP y Pi se unen a una subunidad que ha pasado de un estado O al estado L.
La cadena transportadora de electrones y la fosforilación producen moléculas de ATP. La oxidación de NADH produce alrededor de 52,12 kcal/mol (218 kJ/mol) de energía libre.
La reacción global para la oxidación de NADH es:
NADH+ 1⁄2 O2 +H+ ↔ H2O+NAD+
La transferencia de los electrones desde NADH y FADH2 se da a través de varios complejos, permitiendo que el cambio de energía libre ΔG° se divida en “paquetes” de energía más pequeños, que se acoplan a la síntesis del ATP.
La oxidación de una molécula de NADH genera la síntesis de tres moléculas de ATP. Mientras que la oxidación de una molécula de FADH2 se acopla a la síntesis de dos ATP.
Estas coenzimas provienen de los procesos de glicolisis y ciclo del ácido cítrico. Por cada molécula de glucosa degradada se terminan produciendo 36 o 38 moléculas de ATP, dependiendo de la ubicación de las células. En el cerebro y músculo esquelético se producen 36 ATP mientras que en tejido muscular se producen 38 ATP.
Todos los organismos, unicelulares y pluricelulares, necesitan una energía mínima en sus células para llevar a cabo los procesos dentro de estas, y a su vez mantener las funciones vitales en el organismo completo.
Los procesos metabólicos requieren energía para llevarse a cabo. La mayor parte de la energía utilizable se obtiene por la degradación de hidratos de carbono y grasas. Dicha energía se deriva del proceso de fosforilación oxidativa.
La tasa de utilización de ATP en las células, controla la síntesis de la misma, y a su vez, debido al acoplamiento de la fosforilación oxidativa con la cadena transportadora de electrones, también regula generalmente la tasa de transporte electrónico.
La fosforilación oxidativa posee un control estricto que asegura que no se genere ATP más rápidamente de lo que es consumido. Existen ciertos pasos en el proceso de transporte de electrones y la fosforilación acoplada que regulan el ritmo de producción de energía.
Las principales vías de producción de energía (ATP celular) son la glucólisis, el ciclo del ácido cítrico y la fosforilación oxidativa. El control coordinado de estos tres procesos regula la síntesis de ATP.
El control de la fosforilación por la relación de acción de masas del ATP depende del aporte preciso de electrones en la cadena transportadora. Esto a su vez depende de la relación [NADH]/[NAD+] que se conserva elevada por la acción de la glucólisis y el ciclo del ácido cítrico.
Este control coordinado se lleva a cabo mediante la regulación de los puntos de control de la glicólisis (PFK inhibida por citrato) y el ciclo del ácido cítrico (Piruvato deshidrogenasa, citrato cintasa, isocitrato deshidrogenasa y α-cetoglutarato deshidrogenasa).
El complejo IV (citocromo c oxidasa) es una enzima regulada por uno de sus sustratos, es decir que su actividad está controlada por el citocromo c reducido (c2+), que a su vez está en equilibrio con la relación de las concentraciones entre [NADH]/[NAD+] y la relación de acción de masas de [ATP]/[ADP] + [Pi].
Cuanto más alta es la relación [NADH]/[NAD+] y más baja la [ATP]/[ADP]+[Pi], más concentración habrá de citocromo [c2+] y mayor será la actividad del complejo IV. Esto se interpreta, por ejemplo, si comparamos organismos con actividades diferentes de reposo y actividad elevada.
En un individuo con actividad física elevada, el consumo de ATP y por lo tanto su hidrólisis a ADP + Pi será muy elevada, generando una diferencia en la relación de acción de masas que ocasiona un aumento en [c2+] y por lo tanto un incremento en la síntesis de ATP. En un individuo en reposo ocurre la situación inversa.
Al final, la velocidad de la fosforilación oxidativa incrementa con la concentración de ADP dentro de la mitocondria. Dicha concentración depende de translocadores ADP-ATP encargados del transporte de nucleótidos de adenina y Pi del citosol a la matriz mitocondrial.
La fosforilación oxidativa resulta influida por ciertos agentes químicos, que permiten que continúe el transporte electrónico sin que ocurra la fosforilación del ADP, desacoplando la producción y conservación de energía.
Estos agentes estimulan la velocidad de consumo de oxígeno de la mitocondria en ausencia de ADP, provocando además un incremento en la hidrólisis de ATP. Actúan eliminando un intermediario o rompiendo un estado de energía de la cadena transportadora de electrones.
El 2,4-dinitrofenol, un ácido débil que pasa a través de las membranas mitocondriales, se encarga de disipar el gradiente de protones, pues se unen a ellos en el lado acídico y los libera en el lado básico.
Este compuesto fue usado como “píldora de adelgazar” pues se encontró que producía un aumento en la respiración, por lo tanto, un incremento en la tasa metabólica y una pérdida de peso asociada. Sin embargo, se demostró que su efecto negativo podía incluso causar la muerte.
La disipación del gradiente protónico produce calor. Las células del tejido adiposo marrón usan el desacoplamiento, controlado hormonalmente, para producir calor. Los mamíferos que hibernan y los recién nacidos que carecen de pelo constan de este tejido que les sirve como una especie de manta térmica.
Los compuestos o agentes inhibidores impiden tanto el consumo de O2 (transporte electrónico) como la fosforilación oxidativa asociada. Estos agentes evitan la formación de ATP mediante el uso de la energía producida en el transporte electrónico. Por lo tanto, la cadena de transporte se detiene al no disponerse dicho consumo de energía.
El antibiótico oligomicina funciona como un inhibidor de la fosforilación en muchas bacterias, impidiendo la estimulación del ADP a la síntesis de ATP.
Existen también los agentes ionóforos, que conforman complejos liposolubles con cationes como K+ y Na+, y pasan a través de la membrana mitocondrial con dichos cationes. La mitocondria entonces, emplea le energía producida en el transporte electrónico para bombear cationes en lugar de sintetizar ATP.
- Alberts, B., Bray, D., Hopkin, K., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. (2004). Essential cell biology. New York: Garland Science.
- Cooper, G. M., Hausman, R. E. & Wright, N. (2010). La célula. (pp. 397-402). Marbán.
- Devlin, T. M. (1992). Textbook of biochemistry: with clinical correlations. John Wiley & Sons, Inc.
- Garrett, R. H., & Grisham, C. M. (2008). Biochemistry. Thomson Brooks/Cole.
- Lodish, H., Darnell, J. E., Berk, A., Kaiser, C. A., Krieger, M., Scott, M. P., & Matsudaira, P. (2008). Mollecular cell biology. Macmillan.
- Nelson, D. L., & Cox, M. M. (2006). Lehninger Principios de Bioquímica4ª edición. Ed Omega. Barcelona.
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana.
