Fósforo: historia, propiedades, estructura, obtención, usos
El fósforo es un elemento no metálico que viene representado por el símbolo químico P y tiene número atómico 15. Presenta tres formas alotrópicas principales: fósforo blanco, rojo y el negro. El fósforo blanco es fosforescente, arde espontáneamente al exponerse al aire y es además altamente venenoso.
El fósforo blanco a 250 ºC de temperatura se convierte en el fósforo rojo; una forma polimérica, insoluble y que no arde en el aire. A temperaturas y presiones elevadas, así como en presencia o no de catalizadores, se obtiene el fósforo negro, el cual se asemeja al grafito y es buen conductor de la electricidad.

El fósforo fue aislado por vez primera por H. Brand, en el año 1669. Para ello utilizó la orina como fuente de este elemento. En 1770, W. Scheele descubrió que también podía aislar fósforo de los huesos.
Posteriormente, debido a la creación del horno eléctrico por J. Burgess Readman (1800), las rocas de fosfato se convirtieron en la principal fuente de producción de fósforo a partir del mineral fluoroapatito, presente en ellas.
El fósforo es el doceavo elemento más abundante de la corteza terrestre, y representa el 0,1% de ella en peso. Además, es el sexto elemento en abundancia en el cuerpo humano; principalmente concentrado en los huesos bajo la forma de hidroxilapatita.
Es pues un elemento esencial para los seres vivos, constituyéndose en uno de los tres nutrientes principales de las plantas. El fósforo forma parte de la estructura química de los ácidos nucleicos; de compuestos de almacenamiento de energía (ATP), coenzimas; y en general, de compuestos del metabolismo.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Peso atómico
- 2.3 Número atómico (Z)
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad (temperatura ambiente)
- 2.7 Calor de fusión
- 2.8 Calor de vaporización
- 2.9 Capacidad calórica molar
- 2.10 Estados de oxidación
- 2.11 Electronegatividad
- 2.12 Energía de ionización
- 2.13 Conductividad térmica
- 2.14 Orden magnético
- 2.15 Isótopos
- 2.16 Fosforescencia
- 2.17 Cambios alotrópicos
- 2.18 Solubilidad
- 2.19 Reactividad
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Aleaciones
- 6 Riesgos
- 7 Usos
- 8 Referencias
En la orina

El fósforo fue aislado por Henning Brand en el año 1669, siendo el primer humano en aislar un elemento. Brand era un alquimista alemán de Hamburgo y logró obtener un compuesto de fósforo a partir de la orina. Para ello, juntó la orina de 50 baldes y permitió que se descompusiera.
Brand luego evaporó la orina y obtuvo un residuo negruzco, que conservó por varios meses. A este le agregó arena y lo calentó, logrando eliminar gases y aceites. Por último, obtuvo un sólido blanco que brillaba en la oscuridad con un color verde, al cual denominó “fuego frío”.
El término ‘fósforo’, casualmente proviene de la palabra griega “Phosphoros” que significa portadora de luz.
Brand no publicó sus resultados experimentales y lo vendió a varios alquimistas, entre ellos: Johann Kraft, Kunckel Lowenstern y Wilhelm Leibniz. Probablemente, alguno de ellos informó del trabajo de Brand a la Academia de Ciencias de Paris, divulgándose así sus investigaciones.
Sin embargo, Brand en realidad no aisló el fósforo, sino el fosfato sódico amoniacal [Na(NH4)PO4]. En 1680, Robert Boyle mejoró el procedimiento de Brand, mediante el cual sí pudo obtener una forma alotrópica del fósforo (P4).
En los huesos
Johan Gottlieb Gahn y Carl Wihelm Scheele establecieron en 1769 que un compuesto del fósforo, el fosfato de calcio, se encontraba en los huesos. Los huesos desgrasados eran sometidos a un proceso de digestión con ácidos fuertes, como el ácido sulfúrico.
Luego el producto de la digestión se calentaba en envases de acero con carbón y hulla, obteniéndose así el fósforo blanco mediante destilación en retortas. Los huesos fueron la fuente principal obtención de fósforo hasta el año 1840, cuando fueron sustituidos para este fin por el guano.
En el guano
El guano es una mezcla de excrementos de las aves y productos de descomposición de las mismas. Se utilizó como una fuente de fósforo y fertilizantes en el siglo XIX.
Las rocas con fosfato pasaron a ser utilizadas en 1850 como una fuente de fósforo. Esto, junto con el invento del horno eléctrico para calcinar las rocas por James Burgess Readman (1888), hizo que las rocas fosfáticas fueran la materia prima principal de producción del fósforo y fertilizantes.
En 1819, se establecieron las fábricas de cerrillas, dando inicio al desarrollo industrial del uso del fósforo.
Dependiendo de la forma alotrópica, puede ser incoloro, blanco ceroso, amarillo, escarlata, rojo, violeta o negro.
30,973 u
15
Fósforo blanco: 44,15 ºC
Fósforo rojo: ~ 590 ºC
Fósforo blanco: 280,5 ºC
Blanco: 1,823 g/cm3
Rojo: 2,2-2,34 g/cm3
Violeta: 2,36 g/cm3
Negro: 2,69 g/cm3
Fósforo blanco: 0,66 kJ/mol
Fósforo blanco: 51,9 kJ/mol
Fósforo blanco: 23,824 J/(mol.K)
-3, -2, -1, +1, +2, +3, +4 y +5
En función de la electronegatividad de los elementos con que se combina, el fósforo puede mostrar el estado de oxidación +3 o -3. El fósforo, a diferencia del nitrógeno, tiende a reaccionar preferentemente con el estado de oxidación +5; tal es el caso del pentóxido de fósforo (P2O5 o P25+O52+).
2,19 en la escala de Pauling
-Primera: 1.101 kJ/mol
-Segunda: 2.190,7 kJ/mol
-Tercera: 2.914 kJ/mol
Fósforo blanco: 0,236 W/(m·K)
Fósforo negro: 12,1 W/(m·K)
Se pone de manifiesto cómo el fósforo negro conduce casi seis veces más el calor que el fósforo blanco.
Los fósforos blanco, rojo, violeta y negro son diamagnéticos.
El fósforo tiene 20 isótopos, siendo los principales: 31P, único isótopo estable con una abundancia del 100%; 32P, isótopo emisor β– y con una vida media de 14,28 días; y 33P, un isótopo emisor β– y con una vida media de 25,3 días.
El fósforo blanco es fosforescente y emite una luz verde en la oscuridad.
El fósforo blanco es inestable y cambia a temperaturas cercanas a 250 ºC a una forma polimérica conocida como fósforo rojo, el cual puede variar de color naranja a purpura. Es una sustancia amorfa, pero puede tornarse en cristalina; no brilla en la oscuridad ni arde en el aire.
El fósforo blanco a temperaturas y presiones elevadas, o en presencia de catalizadores, se transforma en una forma polimérica distinta al fósforo rojo: el fósforo negro. Este es una sustancia cristalina de color negro, inerte, semejante al grafito, y que posee capacidad de conducir la electricidad.
El fósforo blanco en forma pura es insoluble en el agua, aunque puede solubilizarse en el sulfuro de carbono. Mientras, los fósforos rojos y negros son insolubles en el agua y son menos volátiles que el fósforo blanco.
El fósforo se quema espontáneamente en el aire para formar el P2O5, y este a su vez puede reaccionar con tres moléculas de agua para formar el ácido ortofosfórico o fosfórico (H3PO4).
Mediante la acción del agua caliente origina la fosfina (PH3) y oxácidos del fósforo.
El ácido fosfórico actúa sobre las rocas fosfatadas originando el fosfato de calcio dihidrogenado o superfosfato [Ca(H2PO4)2].
Puede reaccionar con los halógenos para formar los haluros PX3, representando X al F, Cl, Br o I; o lo haluros con fórmula PX5, siendo X el F, Cl o Br.
Asimismo, el fósforo reacciona con metales y metaloides para originar fosfuros, y con el azufre para formar varios sulfuros. Por otro lado, se une al oxígeno para originar esteres. De la misma manera, se combina con el carbono para formar los compuestos orgánicos fosforados.
Los átomos de fósforo tienen la siguiente configuración electrónica:
[Ne] 3s2 3p3
Tiene por tanto cinco electrones de valencia, tal como el nitrógeno y los otros elementos del grupo 15. Por tratarse de un elemento no metálico, sus átomos necesitan formar enlaces covalentes hasta completar el octeto de valencia. El nitrógeno lo consigue al establecerse como moléculas diatómicas N2, con un triple enlace, N≡N.
Lo mismo sucede con el fósforo: dos de sus átomos P se enlazan con un triple enlace para formar la molécula P2, P≡P; este es, el alótropo difósforo. Sin embargo, el fósforo tiene mayor masa atómica que el nitrógeno, y sus orbitales 3p, más difusos que los 2p del nitrógeno, se traslapan con menor eficacia; por lo tanto, el P2 solo existe en el estado gaseoso.
En su lugar, a temperatura ambiente los átomos P prefieren organizarse covalentemente de otra manera: en una molécula tetraédrica P4:

Nótese que en la imagen superior todos los átomos P tienen tres enlaces simples en lugar de un triple enlace. Así pues, el fósforo en el P4 completa su octeto de valencia. No obstante, en el P4 hay tensión en los enlaces P-P, ya que sus ángulos distan a simple vista de ser 109,5 º.
Fósforo blanco
La misma imagen de las unidades P4 y su inestabilidad explican por qué el fósforo blanco es el alótropo más inestable de este elemento.
Las unidades P4 se ordenan en el espacio para definir un cristal bcc (fase α) en condiciones normales. Cuando la temperatura desciende hasta los -77,95 ºC, el cristal bcc se transforma en uno hcp (presumiblemente), más denso (fase β). Es decir, las unidades P4 se ordenan en dos capas alternadas, A y B, para establecer una secuencia ABAB…
Fósforo rojo
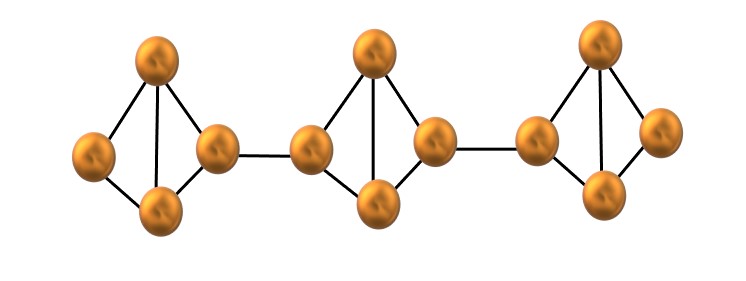
En la imagen superior se muestra apenas un reducido segmento de la estructura del fósforo rojo. Al estar las tres unidades alineadas “simétricamente”, puede decirse que se trata de una estructura cristalina, la cual se obtiene al calentar este fósforo por encima de los 250 ºC.
El fósforo rojo, sin embargo, la mayoría de las veces consiste de un sólido amorfo, por lo que su estructura es desordenada. Entonces, las cadenas poliméricas de P4 se dispondrían sin patrón aparente, unas arriba y otras debajo de un mismo plano arbitrariamente.
Nótese que esta es la principal diferencia estructural entre el fósforo blanco y rojo: en el primero los P4 se hallan individuales, y en el segundo formando cadenas. Esto es posible porque se rompe uno de los enlaces P-P dentro del tetraedro para poder enlazarse al tetraedro vecino. Así, se reduce la tensión anular y el fósforo rojo cobra mayor estabilidad.
Cuando hay una mezcla de ambos alótropos, se ofrece a la vista como un fósforo amarillo; una mezcla de tetraedros y de cadenas amorfas de fósforo. De hecho, el fósforo blanco se torna amarillento al exponerse a los rayos del sol, pues la radiación favorece el rompimiento del enlace P-P ya mencionado.
Fósforo violeta o de Hittorf
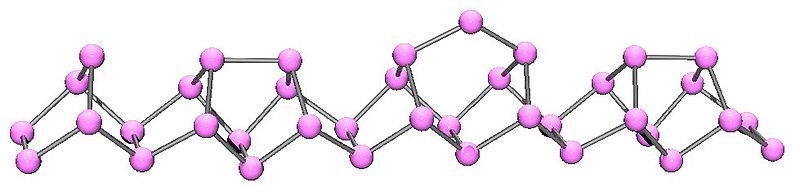
El fósforo violeta es la evolución final del fósforo rojo. Como se aprecia en la imagen superior, sigue consistiendo de una cadena polimérica; pero ahora las estructuras son más intrincadas. Pareciera que la unidad estructural ya no es el P4 sino el P2, dispuesto de tal modo que forman anillos pentagonales irregulares.
A pesar de lo asimétrica que luce la estructura, estas cadenas poliméricas logran ordenarse lo suficiente bien y con periodicidad para que el fósforo violeta establezca cristales monoclínicos.
Fósforo negro
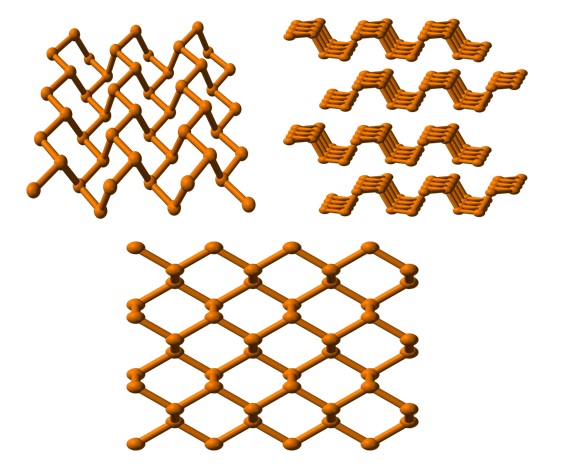
Y finalmente tenemos el alótropo de fósforo más estable: el de color negro. Se prepara calentando el fósforo blanco bajo una presión de 12.000 atm.
En la imagen superior (abajo), puede verse que su estructura, desde un plano superior, tiene cierto parecido con la del grafito; es una red escarpada de anillos hexagonales (aunque parezcan cuadrados).
En la esquina superior izquierda de la imagen, puede apreciarse mejor lo recién comentado. Los entornos moleculares de los átomos P son pirámide trigonales. Nótese que la estructura vista lateralmente (esquina superior derecha), se dispone en capas que calzan unas sobre las otras.
La estructura del fósforo negro es bastante simétrica y ordenada, lo cual concuerda con su capacidad de establecerse como cristales ortorrómbicos. El apilamiento de sus capas poliméricas hace que los átomos P no estén disponibles para muchas reacciones químicas; y es por eso que es considerablemente estable y poco reactivo.
Aunque no esté de más mencionarlo, las fuerzas de dispersión de London y las masas molares de estos sólidos fosfóricos son las que rigen algunas de sus propiedades físicas; mientras que sus estructuras y enlaces P-P, definen las propiedades químicas y otras.
Es el doceavo elemento de la corteza terrestre y representa el 0,1% de ella en peso. Hay alrededor de 550 minerales que contienen fósforo, siendo la apatita el mineral de mayor importancia para la obtención del fósforo.
La apatita es un mineral de fósforo y calcio que puede contener cantidades variables de flúor, cloruro e hidróxido, cuya fórmula es la siguiente: [Ca10(PO4)6(F, Cl o OH)2)]. Además de la apatita existen otros minerales fosforados de importancia comercial; tal es el caso de la wavelita y la vivianita.
La roca de fosfato o fosforita es la fuente principal de fósforo. Es una roca sedimentaria no detrítica que posee un contenido en fósforo de 15-20%. El fósforo suele estar presente como Ca10(PO4)6F2 (fluoroapatita). También está presente como hidroxiapatita, aunque en menor proporción.
Adicionalmente, la fluoroapatita puede encontrarse formando parte de las rocas ígneas y metamórficas, así como de calizas y esquistos.
Las rocas de fosfatos seleccionadas son trasladadas a la planta de tratamiento para su procesamiento. Inicialmente, se trituran para obtener fragmentos rocosos que luego se muelen en molinos de bolas a 70 revoluciones por minuto.
Luego, se procede a tamizar el producto de la molienda de los fragmentos rocosos para poder fraccionarlas. Se eligen aquellas fracciones con un contenido de fósforo del 34% como pentóxido de fósforo (P2O5).
El fósforo blanco (P4) se obtiene industrialmente por la reducción electrotérmica de la fluoroapatita con carbono a una temperatura de 1.500 ºC en presencia de óxido de silicio:
2Ca3(PO4)2(s) + 6SiO2(s) + 10 C (s) => P4(g) + CaSiO3(l) + CO(g)
El P4 en estado gaseoso, luego de condensarse, se recoge y almacena como un sólido blanco sumergido en el agua para evitar que reaccione con el aire externo.
El cubre fosforado se fabrica con diferentes porcentajes de cobre y fósforo: Cu 94 % – P 6%; Cu 92% – P 8%; Cu 85% – P 15%, etc. La aleación se usa como desoxidante, agente humectante para la industria del cobre y además como nucleante en la industria del aluminio.
Son aleaciones de cobre, fósforo y estaño que contienen 0,5 – 11% de fósforo y 0,01 – 0,35% de estaño. El estaño aumenta la resistencia a la corrosión, mientras el fósforo aumenta la resistencia al desgaste de la aleación y le da rigidez.
Se usa en la elaboración de resortes, pernos y, en general, en los artículos que requieren de resistencia a la fatiga, al desgaste y a la corrosión química. Se recomienda su empleo en las hélices de las embarcaciones.
La aleación más conocida es la NiP20, usándose el níquel fosforado en las aleaciones de soldadura fuerte, para mejorar su resistencia a la erosión química, la oxidación y las altas temperaturas.
La aleación se utiliza en componentes de turbinas de gas y motores a reacción, galvanoplastia, y en la producción de electrodos de soldadura.
El fósforo blanco produce quemaduras graves de la piel y es un potente veneno que puede ser mortal a dosis de 50 mg. El fósforo inhibe la oxidación celular, interfiriendo con el manejo celular del oxígeno, lo que puede llevar a una degeneración grasa y a la muerte de la célula.
La intoxicación aguda con fósforo produce dentro de los primeros cuatro días de la ingesta dolor abdominal, ardor, aliento con olor a ajo, vómitos fosforescentes, sudoración, calambres musculares, e inclusive un estado de shock.
Posteriormente, se manifiesta una ictericia, petequias, hemorragia, afectación miocárdica con arritmias, alteración del sistema nervioso central y la muerte al décimo día de la ingesta.
La manifestación más evidente de una intoxicación crónica con fósforo es un daño en la estructura ósea de la mandíbula.
Un aumento en la concentración plasmática de fósforo (hiperfosfatemia), se suele presentar en pacientes con insuficiencia renal. Esto les provoca un depósito anormal de fosfatos en los tejidos blandos, el cual puede llevar a una disfunción vascular y a la enfermedad cardiovascular.
El fósforo es un elemento esencial para las plantas y los animales. Es uno de los tres nutrientes principales de las plantas, siendo necesario para su crecimiento y requerimientos energéticos. Además, forma parte de los ácidos nucleicos, los fosfolipidos, los productos intermedios de los procesos metabólicos, etc.
En los vertebrados el fósforo está presente en los huesos y los dientes bajo la forma de hidroxilapatita.

Con el fósforo se fabrica un esmalte químico que se utiliza para iluminar avisos colocados sobre el aluminio y sus aleaciones; así como en el cobre y el bronce fosforados.
También se usa para fabricar bombas incendiarias, granadas, bombas de humo y balas trazadoras. El fósforo rojo se utiliza en la elaboración de cerillas o fósforos de seguridad.
El fósforo blanco se emplea para la elaboración de organofosforados. Además, se utiliza en la producción del ácido fosfórico.
Una gran cantidad del fósforo producido es incinerado para la producción de tetraóxido de fósforo (P4O10), obtenido como un polvo o un sólido.
Fosfina
Es la materia prima para la elaboración de varios compuestos de fósforo. Actúa como un agente dopante para componentes electrónicos.
Ácido fosfórico
Se emplea en la elaboración de los refrescos debido al sabor característico que les confiere. Actúa sobre las rocas fosfatos para formar el fosfato de calcio dihidrogenado [Ca(H2PO4)2], también conocido como el superfosfato, el cual se utiliza como fertilizante.
El ácido fosfórico es un elemento acondicionador del esmalte dental para facilitar la adhesión de los materiales de su restauración. También se emplea, mezclado con aceite, urea, brea, betún y arena, para formar el asfalto; material utilizado en la reparación de las vías de comunicación terrestres.
Organofosforados
Los compuestos organofosforados tienen numerosas aplicaciones; tales como: retardantes de las llamas, pesticidas, agentes de extracción, agentes de acción nerviosa y para el tratamiento de agua.
Fosfato de calcio dihidrogenado dihidrato
Se usa como fertilizante, polvo para hornear, aditivo para alimento de animales y en la elaboración de pastas dentales.
Pentóxido de fósforo
Se utiliza en el análisis químico como agente deshidratante y en la síntesis orgánica como un agente condensante. El compuesto se destina principalmente para la producción de ácido ortofosfórico.
Tripolifosfato de sodio
Se utiliza en detergentes y como ablandador del agua, lo cual mejora la acción de los detergentes y ayuda a evitar la corrosión de las tuberías.
Fosfato trisódico
Se usa como agente de limpieza y suavizador del agua.
Fosfatos sódicos
El fosfato de sodio dibásico (Na2HPO4) y el fosfato de sodio monobásico (NaH2PO4) son los componentes de un sistema amortiguador de pH, que inclusive actúa en los seres vivos; entre ellos los seres humanos.
- Reid Danielle. (2019). Allotropes of Phosphorus: Forms, Uses & Examples. Study. Recuperado de: study.com
- Prof. Robert J. Lancashire. (2014). Lecture 5c. Structure of the elements, continued P, S and I. Recuperado de: chem.uwimona.edu.jm
- BYJU’S. (2019). Red Phosphorus. Recuperado de: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et al. (2019). Electronic Structural and Optical Properties of Multilayer Blue Phosphorus: A First-Principle Study. Journal of Nanomaterials, vol. 2019, Article ID 4020762, 8 pages. doi.org/10.1155/2019/4020762
- Dr. Dough Stewar. (2019). Phosphorus Element Facts. Chemicool. Recuperado de: chemicool.com
- Wikipedia. (2019). Phosphorus. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (03 de julio de 2019). Phosphorus Facts (Atomic Number 15 or Element Symbol P). Recuperado de: thoughtco.com
- Linus Pauling Institute. (2019). Phosphorus. Recuperado de: lpi.oregonstate.edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.f.). Procesamiento de roca fosfórica nacional para producción de superfosfato. [PDF]. Recuperado de: bdigital.unal.edu.co
- The Editors of Encyclopaedia Britannica. (16 de noviembre de 2018). Phosphorus Chemical Element. Encyclopædia Britannica. Recuperado de: britannica.com
- Reade International Corp. (2018). Copper Phosphorus (CuP) Alloy. Recuperado de: reade.com
- KBM Affilips. (27 de diciembre de 2018). Nickel Phosphorus (NiP) Master Alloy. AZoM. Recuperado de: azom.com
- Lenntech B.V. (2019). Periodic table: phosphorus. Recuperado de: lenntech.com
- Abhijit Naik. (21 de febrero de 2018). Phosphorus uses. Recuperado de: sciencestruck.com
