Capilaridad: características y ejemplo en el agua
La capilaridad es una propiedad de los líquidos que les permite desplazarse por orificios tubulares o superficies porosas aun en contra de la fuerza de gravedad. Para ello, debe haber un equilibrio y coordinación de dos fuerzas relacionadas con las moléculas del líquido: cohesión y adhesión; teniendo estas dos un reflejo físico llamado tensión superficial.
El líquido necesita poder mojar las paredes internas del tubo o los poros del material por el que se desplaza. Esto ocurre cuando la fuerza de adhesión (líquido-pared del tubo capilar) es mayor que la fuerza de cohesión intermolecular. En consecuencia, las moléculas del líquido crean interacciones más fuertes con los átomos del material (vidrio, papel, etc.) que entre ellas.
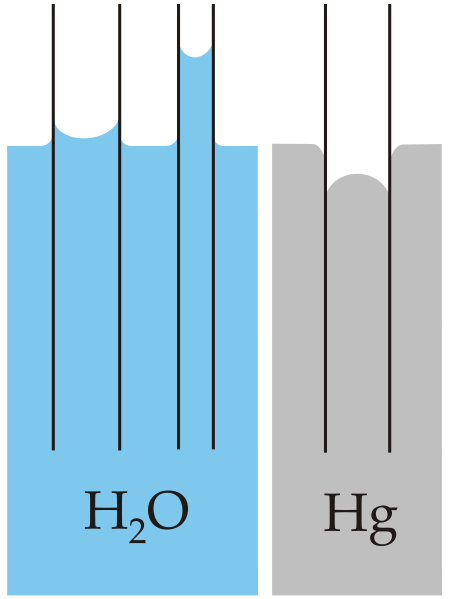
El ejemplo clásico de capilaridad viene ilustrado en la comparación de esta propiedad para dos líquidos muy diferentes: el agua y mercurio.
En la imagen superior se aprecia que el agua sí asciende por las paredes del tubo, lo que significa que presenta mayores fuerzas de adhesión; mientras que con el mercurio ocurre todo lo contrario, debido a que sus fuerzas de cohesión, de enlace metálico, le impide mojar el vidrio.
Por esta razón el agua forma un menisco cóncavo, y el mercurio un menisco convexo (con forma de domo). Asimismo cabe resaltar que mientras menor sea el radio del tubo o la sección por la que se desplaza el líquido, mayor será la altura o distancia recorrida (compare las alturas de las columnas de agua para ambos tubos).
Índice del artículo
La superficie del líquido, a decir agua, en un capilar es cóncava; es decir, el menisco es cóncavo. Esta situación se produce porque la resultante de las fuerzas que se ejercen sobre las moléculas de agua próximas a la pared del tubo está dirigida hacia esta.
En todo menisco existe un ángulo de contacto (θ), el cual es el ángulo que forma la pared del tubo capilar con una línea tangente a la superficie del líquido en el punto de contacto.
Fuerzas de adhesión y cohesión
Si la fuerza de adhesión del líquido a la pared capilar prevalece sobre la fuerza de cohesión intermolecular, entonces el ángulo es θ 90º; el líquido moja la pared capilar y el agua asciende por el capilar, observándose el fenómeno conocido como capilaridad.
Cuando se coloca una gota de agua sobre la superficie de un vidrio limpio, el agua se extiende sobre el vidrio, por lo que θ = 0 y el cos θ =1.
Si la fuerza de cohesión intermolecular prevalece sobre la fuerza de adhesión líquido-pared del capilar, por ejemplo en el mercurio, el menisco será convexo y el angulo θ tendrá un valor >90º; el mercurio no moja la pared capilar y por tanto desciende por su pared interna.
Cuando se coloca una gota de mercurio sobre la superficie de un vidrio limpio, la gota mantiene su forma y el ángulo θ = 140º.
El agua asciende por el tubo capilar hasta alcanzar una altura (h), en la cual el peso de la columna de agua compensa al componente vertical de la fuerza de cohesión intermolecular.
A medida que asciende más agua, llegará un punto donde la gravedad detendrá su ascenso, aun con la tensión superficial obrando a su favor.
Cuando esto ocurre, las moléculas no pueden continuar “trepando” por las paredes internas, y todas las fuerzas físicas se igualan. Por un lado se tienen las fuerzas que promueven el ascenso del agua, y por el otro su propio peso empujándola hacia abajo.
Ley de Jurin
Esto puede escribirse matemáticamente como sigue a continuación:
2 π rϒcosθ = ρgπr2h
Donde el lado izquierdo de la ecuación depende de la tensión superficial, cuya magnitud asimismo se relaciona con las fuerzas de cohesión o intermoleculares; Cosθ representa el ángulo de contacto, y r el radio del orificio por el que asciende el líquido.
Y en el lado derecho de la ecuación se tiene la altura h, la fuerza de gravedad g, y la densidad del líquido; que vendría a ser la del agua.
Despejando entonces h se tiene
h = (2ϒcosθ / ρgr)
Esta formulación es conocida como Ley de Jurin, que define la altura alcanzada por la columna de líquido, en el tubo capilar, cuando se equilibra el peso de la columna de líquido con la fuerza de ascensión por capilaridad.
El agua es una molécula dipolar, debido a la electronegatividad del átomo de oxígeno y su geometría molecular. Esto hace que la porción de la molécula de agua donde está ubicado el oxígeno se cargue negativamente, mientras la porción de la molécula de agua, contentiva de los 2 átomos de hidrógeno, se carga positivamente.
Las moléculas en el seno del líquido interaccionan gracias a esto mediante múltiples puentes de hidrógeno, manteniéndoles unidas. Sin embargo, las moléculas de agua que están en la interfase agua:aire (superficie), están sometidas a una atracción neta por las moléculas del seno del líquido, no compensada por la débil atracción con las moléculas de aire.
Por lo tanto, las moléculas de agua de la interfase están sometidas a una fuerza de atracción que tiende a retirar moléculas de agua de la interfase; es decir, los puentes de hidrógeno formados con las moléculas del fondo arrastra a las que se hallan en la superficie. Así, la tensión superficial busca disminuir la superficie de la interfase agua:aire.
Relación con h
Si se observa la ecuación de la ley de Jurin, se encontrará que h es directamente proporcional a ϒ; por lo tanto, mientras mayor sea la tensión superficial del líquido, mayor será la altura que pueda ascender por un capilar o poro de un material.
De esta manera cabe esperarse que para dos líquidos, A y B, con tensiones superficiales diferentes, aquel con mayor tensión superficial ascienda a una altura más alta.
Se puede concluir respecto a este punto que una tensión superficial alta es la característica más importante que define la propiedad de capilaridad de un líquido.
La observación de la Ley de Jurin señala que la altura que alcanza un líquido en un capilar o poro es inversamente proporcional al radio de los mismos.
Por lo tanto, mientras menor sea el radio, mayor será la altura que alcance la columna del líquido por capilaridad. Esto puede observarse directamente en la imagen donde se compara el agua con el mercurio.
En un tubo de vidrio con un radio de 0,05 mm de radio, la columna de agua por capilaridad alcanzará una altura de 30 cm. En los tubos capilares con un radio de 1 µm con una presión de succión de 1,5 x 103 hPa (lo que es igual a 1,5 atm) corresponde a un cálculo de la altura de la columna de agua de 14 a 15 m.
Esto es muy similar a lo que ocurre con esas pajillas que dan vueltas en sí misma varias veces. Al sorber el líquido, se crea una diferencia de presión que hace que el líquido ascienda hasta la boca.
El valor de altura máxima de la columna alcanzada por capilaridad es teórico, ya que el radio de los capilares no puede ser reducido más allá de un cierto límite.
Ley de Poiseuille
Esta establece que el flujo de un líquido real viene dado por la expresión siguiente:
Q = (πr4/8ηl) ΔP
Donde Q es el flujo del líquido, η es su viscosidad, l la longitud del tubo, y ΔP la diferencia de presión.
Al disminuir el radio de un capilar, debería aumentar en forma indefinida la altura de la columna de líquido alcanzada por capilaridad. Sin embargo, Poiseuille señala que al disminuir el radio, disminuye igualmente el flujo del líquido a través de ese capilar.
Además, la viscosidad, que es una medida de la resistencia que se opone al flujo de un líquido real, disminuiría aún más el flujo del líquido.
Mientras mayor sea el valor del cosθ, mayor será la altura de la columna de agua por capilaridad, tal como lo señala la Ley de Jurin.
Si θ es pequeño y se acerca a cero (0), el cosθ es = 1, por lo que el valor h será máximo. Por el contrario, si θ es igual a 90º, el cosθ = 0 y el valor de h = 0.
Cuando el valor de θ es mayor de 90º, que es el caso del menisco convexo, el líquido no asciende por capilaridad y su tendencia es a descender (como ocurre con el mercurio).
El agua presenta un valor de tensión superficial de 72,75 N/m, relativamente alto en comparación con los valores para tensión superficial de los líquidos siguientes:
-Acetona: 22,75 N/m
-Alcohol etílico: 22,75 N/m
-Hexano: 18,43 N/m
-Metanol: 22,61 N/m.
Por lo tanto, el agua tiene una tensión superficial excepcional, lo que favorece el desarrollo del fenómeno de capilaridad tan necesario para la absorción de agua y nutrientes por las plantas.
La capilaridad es un mecanismo importante para el ascenso de la savia por el xilema de las plantas, pero es insuficiente por sí sola para hacer llegar la savia a las hojas de los árboles.
La transpiración o evaporación es un mecanismo importante en el ascenso de la savia por el xilema de las plantas. Las hojas pierden agua mediante su evaporación, generando una disminución en la cantidad de las moléculas de agua, lo que provoca una atracción de las moléculas de agua presentes en los tubos capilares (xilema).
Las moléculas de agua no actúan independientemente unas de otras, sino que interaccionan por las fuerzas de Van der Waals, lo que hace que asciendan enlazadas entre sí por los tubos capilares de las plantas hacia las hojas.
Además de estos mecanismos, debe señalarse que las plantas absorben agua del suelo por ósmosis y que una presión positiva generada en la raíz, impulsa el inicio del ascenso del agua por los tubos capilares de la planta.
- García Franco A. (2010). Fenómenos superficiales. Recuperado de: sc.ehu.es
- Fenómenos de superficie: tensión superficial y capilaridad. [PDF]. Recuperado de: ugr.es
- Wikipedia. (2018). Capilaridad. Recuperado de: es.wikipedia.org
- Risvhan T. (s.f.).Capilaridad en las plantas. Recuperado de: academia.edu
- Helmenstine, Anne Marie, Ph.D. (22 de diciembre de 2018). Capillary Action: Definition and Examples. Recuperado de: thoughtco.com
- Ellen Ellis M. (2018). Capillary Action of Water: Definition & Examples. Study. Recuperado de: study.com
- ScienceStruck Staff. (16 de julio de 2017). Examples That Explain the Concept and Meaning of Capillary Action. Recuperado de: sciencestruck.com
