Oxígeno: propiedades, estructura, riesgos, usos
El oxígeno es un elemento químico que viene representado por el símbolo O. Se trata de un gas muy reactivo, el cual encabeza el grupo 16: los calcógenos. Este nombre se debe a que el azufre y el oxígeno están presentes en casi todos los minerales.
Su alta electronegatividad explica su gran avidez por los electrones, lo cual lo lleva a combinarse con un número elevado de elementos; es así que surge un amplio abanico de óxidos minerales que enriquecen la corteza terrestre. Así, el oxígeno remanente compone y hace que la atmósfera sea respirable.

El oxígeno es el tercer elemento en abundancia en el Universo, detrás del hidrógeno y el helio, y es además el principal constituyente en masa de la corteza terrestre. Tiene un porcentaje en volumen del 20,8% de la atmósfera terrestre, y representa el 89% de la masa de agua.
Tiene habitualmente dos formas alotrópicas: el oxígeno diatómico (O2), que es la forma más frecuente en la naturaleza, y el ozono (O3), encontrado en la estratósfera. Sin embargo, hay otras dos (O4 y O8) que existen en sus fases líquidas o sólidas, y bajo enormes presiones.
El oxígeno se produce constantemente a través del proceso de fotosíntesis, realizados por el fitoplancton y las plantas terrestres. Una vez producido, es liberado para que los seres vivos puedan utilizarlo, mientras que una pequeña porción de él se disuelve en los mares, sustentando vida acuática.
Es pues, un elemento esencial para los seres vivos; no solo porque está presente en la mayor parte de los compuestos y moléculas que los forman, sino porque además interviene en todos sus procesos metabólicos.
Aunque controversialmente se atribuye su aislamiento a Carl Scheele y Joseph Priestley en 1774, hay indicios de que el oxígeno fue en realidad aislado por vez primera en 1608, por Michael Sendivogius.
Este gas se usa en la práctica médica para mejorar las condiciones de vida de pacientes con dificultades respiratorias. Asimismo, el oxígeno es empleado para permitir que las personas cumplan sus funciones en ambientes en que está disminuido o no hay acceso al oxígeno atmosférico.
El oxígeno producido comercialmente se utiliza principalmente en la industria metalúrgica para la conversión del hierro en acero.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Peso atómico
- 2.3 Número atómico (Z)
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Punto triple
- 2.8 Punto crítico
- 2.9 Calor de fusión
- 2.10 Calor de vaporización
- 2.11 Capacidad calórica molar
- 2.12 Presión de vapor
- 2.13 Estados de oxidación
- 2.14 Electronegatividad
- 2.15 Energía de ionización
- 2.16 Orden magnético
- 2.17 Solubilidad en agua
- 2.18 Reactividad
- 2.19 Isótopos
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y producción
- 5 Papel biológico
- 6 Riesgos
- 7 Usos
- 8 Referencias
En 1500, Leonardo da Vinci, basándose en los experimentos de Philo de Bizancio realizados en el siglo II a. C., concluyó que una porción del aire se consumía durante la combustión y la respiración.
En 1608, Cornelius Drebble mostró que calentando salpetre (nitrato de plata, KNO3) se producía un gas. Este gas, como se conocería luego, era oxígeno; pero Drebble no pudo identificarlo como un nuevo elemento.
Luego, en 1668, John Majow señaló que una parte del aire que él denominó “Spiritus nitroaerus” era responsable del fuego, y que además, se consumía durante la respiración y la combustión de sustancias. Majow observó que las sustancias no ardían en ausencia del espíritu nitroarial.
Majow realizó la combustión del antimonio, y observó un aumento en el peso del antimonio durante su combustión. Entonces, Majow concluyó que el antimonio se combinaba con el espíritu nitroarial.
Aunque no recibió el reconocimiento de la comunidad científica, en vida ni después de su muerte, es probable que Michael Sandivogius (1604) sea el verdadero descubridor del oxígeno.
Sandivogius era un alquimista, filósofo y médico sueco que produjo la descomposición térmica del nitrato de potasio. Sus experimentos lo llevó a la liberación del oxígeno, al cual denominó como “cibus vitae”: alimento de la vida.
Entre 1771 y 1772, el químico sueco Carl W Scheele calentó varios compuestos: nitrato de potasio, óxido de manganeso y óxido de mercurio. Scheele observó que se liberaba de ellos un gas que incrementaba la combustión, y al cual él denominó “aire de fuego”.
En 1774, el químico inglés Joseph Priestly calentó óxido de mercurio mediante el uso de una lente de aumento de doce pulgadas que concentraba la luz solar. El óxido de mercurio liberó un gas que hizo que la vela se quemara mucho más rápido de lo normal.
Además, Priestly probó el efecto biológico del gas. Para ello, colocó en un recipiente cerrado un ratón que esperaba que sobreviviera quince minutos; sin embargo, en presencia del gas sobrevivió una hora, más de lo que estimaba.
Priestly publicó sus resultados en 1774; mientras que Scheele lo hizo en 1775. Por esta razón, se suele atribuir el descubrimiento del oxígeno a Priestly.
Antoine Lavoisier, químico francés (1777), descubrió que el aire contiene un 20% de oxígeno y que cuando una sustancia se quema, en realidad está combinándose con el oxígeno.
Lavoisier concluyó que el aparente aumento de peso que experimentaban las sustancias durante su combustión era debido a la pérdida de peso que ocurre en el aire; ya que el oxígeno se combinaba con estas sustancias y, por lo tanto, las masas de los reactantes se conservaban.
Esto permitió a Lavoisier el establecimiento de la Ley de la Conservación de la Materia. Lavoisier sugirió el nombre de oxígeno que provenía de la raíz “oxys” ácido y “genes” formación. Entonces oxígeno significa ‘formador de ácidos’.
Este nombre es erróneo, ya que no todos los ácidos contienen oxígeno; por ejemplo, los halogenuros de hidrógeno (HF, HCl, HBr y HI).
Dalton (1810) asignó al agua la fórmula químico HO y por lo tanto, el peso atómico del oxígeno era de 8. Un grupo de químicos, entre ellos: Davy (1812) y Berzelius (1814) corrigieron el planteamiento de Dalton y concluyeron que la fórmula correcta del agua es H2O y el peso atómico del oxígeno es 16.
Gas incoloro, inodoro e insípido; mientras que el ozono tiene un olor acre. El oxígeno favorece la combustión, pero en sí mismo no es un combustible.

En su forma líquida (imagen superior) es de color azul pálido, y sus cristales también son azulados; pero pueden adquirir tonalidades rosadas, anaranjadas, e inclusive, rojizas (tal como se explicará en el apartado de su estructura).
15,999 u.
8.
-218,79 ºC.
-182,962 ºC.
En condiciones normales: 1,429 g/L. El oxígeno es un gas más denso que el aire. Además, es un mal conductor del calor y la electricidad. Y en su punto de ebullición (líquido), la densidad es 1,141 g/mL.
54,361 K y 0,1463 kPa (14,44 atm).
154,581 K y 5,043 MPa (49770,54 atm).
0,444 kJ/mol.
6,82 kJ/mol.
29,378 J/(mol·K).
A una temperatura de 90 K tiene una presión de vapor de 986,92 atm.
-2, -1, +1, +2. El estado de oxidación más importante es el -2 (O2-).
3,44 en la escala de Pauling
Primera: 1.313,9 kJ/mol.
Segunda: 3.388,3 kJ/mol.
Tercera: 5.300,5 kJ/mol.
Paramagnético.
La solubilidad del oxígeno en agua disminuye a medida que aumenta la temperatura. Así por ejemplo: se disuelve 14,6 mL de oxígeno/L de agua a 0 ºC y 7,6 mL de oxígeno/L de agua a 20 ºC. La solubilidad del oxígeno en el agua potable es mayor que en el agua de mar.
En la condición de temperatura 25 ºC y a una presión 101,3 kPa, el agua potable puede contener 6,04 mL de oxígeno/L de agua; mientras que el agua de agua de mar solo 4,95 mL de oxígeno/L de agua.
El oxígeno es un gas altamente reactivo que reacciona directamente con casi todos los elementos a temperatura ambiente y altas temperaturas; a excepción de los metales con potenciales de reducción más altos que el cobre.
También puede reaccionar con los compuestos, oxidando a los elementos presentes en ellos. Esto es lo que sucede cuando reacciona con la glucosa, por ejemplo, para producir agua y dióxido de carbono; o cuando arde la madera o un hidrocarburo.
El oxígeno puede aceptar electrones por transferencia completa o parcial, por lo que se le considera un agente oxidante.
El número o estado de oxidación más común para el oxígeno es el -2. Con este número de oxidación se encuentra en el agua (H2O), dióxido de azufre (SO2) y dióxido de carbono (CO2).
Asimismo, en compuestos orgánicos como aldehídos, alcoholes, ácidos carboxílicos; ácidos comunes como H2SO4, H2CO3, HNO3; y en sus sales derivadas: Na2SO4, Na2CO3 o KNO3. En todos ellos se pudiera asumir la existencia del O2- (lo cual no es cierto para los compuestos orgánicos).
Óxidos
El oxígeno está presente como O2- en las estructuras cristalinas de los óxidos metálicos.
Por otro lado, en los superóxidos metálicos, como el superóxido de potasio (KO2), el oxígeno está como el ion O2–. Mientras que en los peróxidos metálicos, a decir el peróxido de bario (BaO2), el oxígeno se presenta como el ion O22- (Ba2+O22-).
El oxígeno presenta tres isótopos estables: 16O, con 99,76% de abundancia; el 17O, con un 0,04%; y el 18O, con un 0,20%. Nótese que el 16O es por lejos el isótopo más estable y abundante.
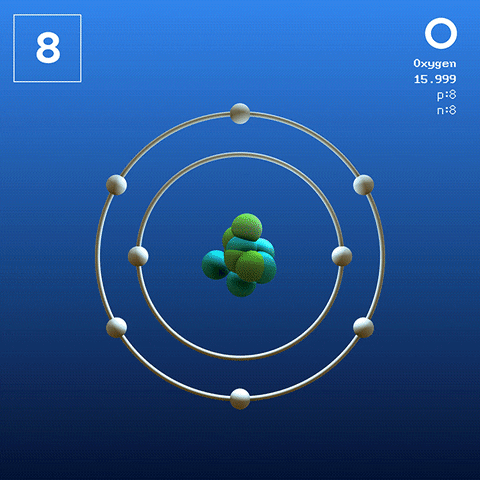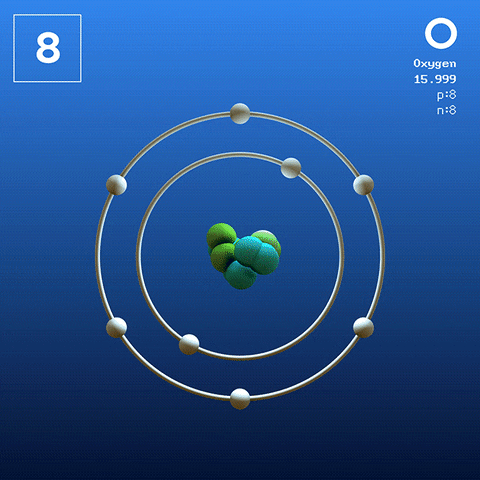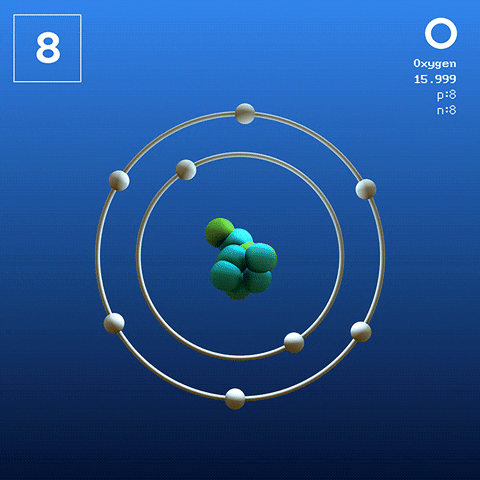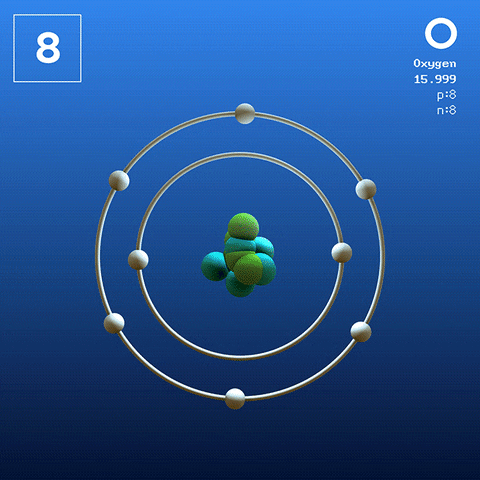
El oxígeno en su estado basal es un átomo cuya configuración electrónica es:
[He] 2s2 2p4
De acuerdo a la teoría del enlace de valencia (TEV), dos átomos de oxígeno se enlazan covalentemente para que ambos por separado completen su octeto de valencia; además de poder aparear sus dos electrones solitarios de los orbitales 2p.
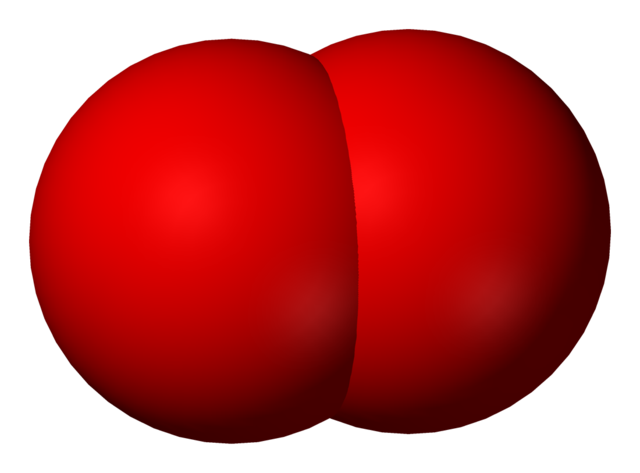
De esta manera pues, aparece la molécula diatómica de oxígeno, O2 (imagen superior), la cual tiene un enlace doble (O=O). Su estabilidad energética es tal, que el oxígeno nunca se halla como átomos individuales en fase gaseosa sino como moléculas.
Debido a que el O2 es homonuclear, lineal y simétrica, carece de momento dipolar permanente; por lo tanto, sus interacciones intermoleculares dependen de su masa molecular y de las fuerzas de dispersión de London. Estas fuerzas son relativamente débiles para el oxígeno, lo cual explica por qué es un gas en condiciones terrestres.
No obstante, cuando la temperatura desciende o aumenta la presión, las moléculas O2 se ven forzadas a cohesionar; hasta el punto que de sus interacciones se vuelven significativas y permiten la formación del oxígeno líquido o sólido. Para intentar comprenderlos molecularmente, es necesario no perder la vista del O2 como unidad estructural.
El oxígeno puede adoptar otras estructuras moleculares considerablemente estables; esto es, se encuentra en la naturaleza (o dentro del laboratorio) en diversas formas alotrópicas. El ozono (imagen inferior), O3, por ejemplo, es el segundo alótropo del oxígeno más conocido.
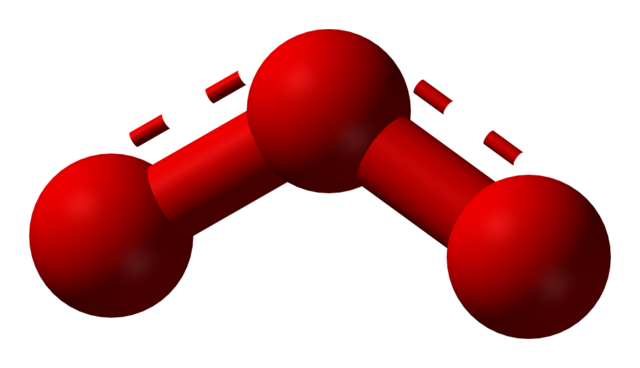
Nuevamente, la TEV sostiene, explica y demuestra que en el O3 debe haber estructuras de resonancia que estabilicen la carga formal positiva del oxígeno del centro (líneas punteadas en rojo); mientras que los oxígenos de los extremos del boomerang se reparten una carga negativa, haciendo que la carga total para el ozono sea neutra.
De esta manera, los enlaces no son simples, pero tampoco dobles. Ejemplos de híbridos de resonancia son muy comunes en otras tantas moléculas o iones inorgánicos.
El O2 y O3, a raíz de que sus estructuras moleculares son diferentes, lo mismo ocurre con sus propiedades físicas y químicas, fases líquidas o cristales (aun cuando ambos consistan de átomos de oxígeno). Teorizan que es probable la síntesis a grandes escalas del ozono cíclico, cuya estructura se asemeja a la de un triángulo rojizo y oxigenado.
Hasta aquí llegan los “alótropos normales” del oxígeno. No obstante, existen otros dos a considerar: O4 y O8, encontrados o propuestos en el oxígeno líquido y sólido, respectivamente.
El oxígeno gaseoso es incoloro, pero cuando la temperatura desciende hasta los -183 ºC, condensa en un líquido de color azul pálido (parecido al celeste). Las interacciones entre las moléculas O2 es ahora tal que incluso sus electrones pueden absorber fotones en la región roja del espectro visible para reflejar su color azul característico.
No obstante, se ha teorizado que en este líquido hay más que simples moléculas O2, sino además una molécula O4 (imagen inferior). Pareciera como si al ozono le hubieran “pegado” otro átomo de oxígeno que de alguna manera intercede por la carga formal positiva recién descrita.
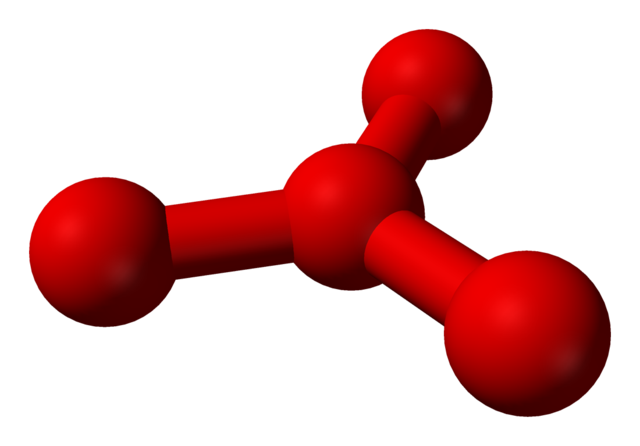
El problema es que de acuerdo a simulaciones computacionales y moleculares, dicha estructura para el O4 no es precisamente estable; sin embargo, predicen que sí existen como unidades (O2)2, es decir, dos moléculas de O2 se aproximan tanto que forman una especie de marco irregular (los átomos O no están alineados uno frente del otro).
Una vez la temperatura descienda hasta los -218,79 ºC, el oxígeno cristaliza en una estructura cúbica simple (fase γ). Conforme la temperatura desciende todavía más, el cristal cúbico sufre transiciones a las fases β (romboédrica y a -229,35 ºC) y α (monoclínica y a -249,35 ºC).
Todas estas fases cristalinas del oxígeno sólido ocurren a presión ambiente (1 atm). Cuando la presión se incrementa a 9 GPa (~9000 atm), aparece la fase δ, cuyos cristales son anaranjados. Si la presión sigue aumentando hasta los 10 GPa, aparece el oxígeno sólido rojo o fase ε (otra vez monoclínico).
La fase ε es especial porque la presión es tan enorme que las moléculas O2 no solo se acomodan como unidades O4, sino también O8:
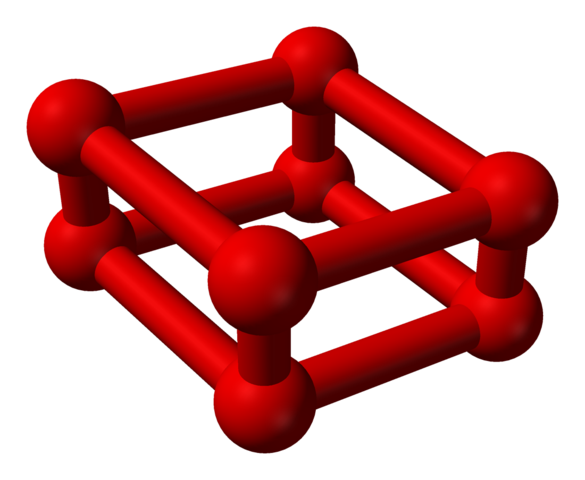
Nótese que este O8 consiste de dos unidades O4 donde se aprecia el marco irregular ya explicado. Asimismo, es válido considerarlo como cuatro O2 alineados estrechamente y en posiciones verticales. Sin embargo, es tal su estabilidad bajo esta presión que el O4 y O8 son dos alótropos adicionales para el oxígeno.
Y finalmente tenemos la fase ζ, metálica (a presiones mayores de 96 GPa), en la cual la presión hace que los electrones se dispersen en el cristal; tal como sucede con los metales.
El oxígeno es en masa el tercer elemento del Universo, detrás del hidrógeno y el helio. Constituye el elemento más abundante de la corteza terrestre, representando alrededor del 50% de su masa. Se encuentra principalmente combinado con el silicio, bajo la forma de óxido de silicio (SiO2).
El oxígeno se encuentra formando parte de innumerables minerales, tales como: cuarzo, talco, feldespatos, hematita, cuprita, brucita, malaquita, limonita, etc. Asimismo, se localiza formando parte de numerosos compuestos como carbonatos, fosfatos, sulfatos, nitratos, etc.
El oxígeno constituye en volumen el 20,8% del aire atmosférico. En la tropósfera se encuentra principalmente como una molécula diatómica de oxígeno. Mientras que en la estratósfera, una capa gaseosa entre 15 y 50 km de la superficie terrestre, se encuentra como el ozono.
El ozono es producido por una descarga eléctrica sobre la molécula de O2. Este alótropo del oxígeno absorbe la luz ultravioleta de las radiaciones solares, bloqueando su acción dañina sobre los seres humanos, que en casos extremos se asocia a la aparición de melanomas.
El oxígeno es un componente principal del agua de mar y el agua dulce de los lagos, ríos y aguas subterráneas. El oxígeno forma parte de la fórmula química del agua, constituyendo en masa el 89% de ella.
Por otro lado, aunque la solubilidad del oxígeno en el agua es relativamente baja, la cantidad de oxígeno disuelta en esta es imprescindible para la vida acuática, la cual incluye numerosísimas especies de animales y algas.
El ser humano está formado, aproximadamente, por un 60% de agua y a la vez, rica en oxígeno. Pero además, el oxígeno forma para parte de numerosos compuestos, como fosfatos, carbonatos, ácidos carboxílicos, cetonas, etc., los cuales son imprescindibles para la vida.
También el oxígeno está presente en los polisacáridos, los lípidos, las proteínas y los ácidos nucleicos; es decir, las llamadas macromoléculas biológicas.
Asimismo forma parte de desechos dañinos de la actividad del hombre, por ejemplo: el monóxido y dióxido de carbono, así como el dióxido de azufre.

El oxígeno se produce durante la fotosíntesis, proceso mediante el cual el fitoplancton marino y las plantas terrestres usan la energía lumínica para hacer reaccionar el dióxido de carbono con el agua, originando glucosa y liberando oxígeno.
Se estima que más del 55% del oxígeno producido por la fotosíntesis es debido a la acción del fitoplancton marino. Por lo tanto, constituye la fuente principal de generación de oxígeno en la Tierra y es responsable del mantenimiento de la vida en ella.
Licuefacción del aire
El método principal de producción de oxígeno en forma industrial es el creado en 1895, de manera independiente por Karl Paul Gottfried Von Linde y William Hamson. Este método se continúa usando en la actualidad con algunas modificaciones.
El proceso se inicia con una compresión del aire para condensar el vapor de agua y así eliminarlo. Luego, el aire es tamizado al ser conducido por una mezcla de zeolita y sílica gel, para la eliminación de dióxido de carbono, hidrocarburos pesados y el resto de agua.
Posteriormente, los componentes del aire líquido son separados a través de una destilación fraccionada, lográndose la separación de los gases presentes en el por sus diferentes puntos de ebullición. Por este método se logra obtener oxígeno con un 99% de pureza.
Electrólisis del agua
El oxígeno es producido por electrólisis de agua altamente purificada, y con una conductividad eléctrica que no excede 1 µS/cm. El agua se separa por electrólisis en sus componentes. El hidrógeno como catión se desplaza hacia el cátodo (-); mientras que el oxígeno se desplaza hacia el ánodo (+).
Los electrodos tienen una estructura especial para recoger los gases y producir posteriormente su licuefacción.
Descomposición térmica
La descomposición térmica de compuestos como óxido de mercurio y salpetre (nitrato de potasio), libera oxígeno, el cual puede ser recogido para su uso. También se usan los peróxidos para este propósito.
El oxígeno es producido por el fitoplancton y las plantas terrestres mediante la fotosíntesis. Atraviesa la pared pulmonar y en la sangre es captada por la hemoglobina, la cual lo transporta a diferentes órganos para luego ser usado en el metabolismo celular.
En este proceso se utiliza el oxígeno durante el metabolismo de los glúcidos, ácidos grasos y aminoácidos, para producir en última instancia dióxido de carbono y energía.
La respiración puede esquematizarse de la manera siguiente:
C6H12O6 + O2 => CO2 + H2O + Energía
La glucosa se metaboliza en un conjunto de procesos químicos secuenciales, que comprende la glucólisis, el ciclo de Krebs, la cadena de transporte electrónico y la fosforilación oxidativa. Esta serie de eventos produce energía que se acumula como ATP (adenosín trifosfato).
El ATP se utiliza en diversos procesos en las células que incluye el transporte de iones y otras sustancias a través de la membrana plasmática; la absorción intestinal de sustancias; la contracción de las diferentes células musculares; el metabolismo de diferentes moléculas, etc.
Los leucocitos polimorfonucleares y los macrófagos son células fagocíticas que son capaces de utilizar el oxígeno para producir el ion superóxido, el peróxido de hidrógeno y el oxígeno singlete, los cuales se utilizan para destruir microorganismos.
Respirar oxígeno a altas presiones puede causar náuseas, mareos, espasmos musculares, pérdida de visión, convulsiones y pérdida de la conciencia. Además, respirar oxígeno puro por un largo período de tiempo provoca irritación pulmonar, manifestada por tos y acortamiento de la respiración.
Asimismo, puede ser causa de la formación de un edema pulmonar: una condición muy grave que limita la función respiratoria.
Una atmósfera con alta concentración de oxígeno puede ser peligrosa, ya que facilita el desarrollo de incendios y explosiones.
El oxígeno es administrado a pacientes que tienen una insuficiencia respiratoria; tal es el caso de los pacientes afectados de neumonía, edema pulmonar o enfisema. No podrían respirar oxígeno ambiental pues se verían seriamente afectados.
Los pacientes con insuficiencia cardíaca en lo que se presenta acumulación líquido en los alvéolos, también necesitan que se les suministre oxígeno; al igual que los pacientes que hayan sufrido un accidente cerebro vascular (ACV) severo.
Los bomberos que están combatiendo un incendio en un ambiente con ventilación inadecuada, requieren el uso de máscaras y bombonas de oxígeno que les permitan cumplir con sus funciones, sin poner en mayores riesgos sus vidas.
Los submarinos están dotados de equipos de producción de oxígeno que les permite a los marineros su permanencia en un ambiente cerrado y sin acceso al aire atmosférico.
Los buzos realizan su trabajo sumergidos en el agua y, por lo tanto, aislados del aire atmosférico. Ellos respiran mediante el oxígeno bombeado por tubos conectados a su escafandra o el uso de bombonas adosadas al cuerpo del submarinista.
Los astronautas realizan sus actividades en ambientes equipados con generadores de oxígenos que permitan la sobrevivencia durante los viajes espaciales y en una estación espacial.
Más del 50% del oxígeno producido industrialmente es consumido en la transformación del hierro en acero. Al hierro fundido se le inyecta un chorro de oxígeno con el fin de eliminar el azufre y el carbono presentes; reaccionan para producir los gases SO2 y CO2, respectivamente.
El acetileno se usa en combinación con el oxígeno para cortar placas de metales y también para producir su soldadura. El oxígeno también se utiliza en la producción de vidrio, aumentando la combustión en el horneado del mismo para mejorar así su transparencia.
La combinación de acetileno y oxígeno se usa para quemar muestras de diferentes orígenes en un espectrofotómetro de absorción atómica.
Durante el procedimiento, se hace incidir sobre la llama un haz de luz proveniente de una lámpara, la cual es específica para el elemento que se desea cuantificar. La llama absorbe la luz de la lámpara, permitiendo la cuantificación del elemento.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Oxygen. Recuperado de: en.wikipedia.org
- Richard Van Noorden. (13 de septiembre de 2006). Just a pretty phase? Solid red oxygen: useless but delightful. Recuperado de: nature.com
- AzoNano. (04 de diciembre de 2006). Solid Oxygen e-Phase Crystal Structure Determined Along With The Discovery of a Red Oxygen O8 Cluster. Recuperado de: azonano.com
- National Center for Biotechnology Information. (2019). Oxygen molecule. PubChem Database. CID=977. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Oxygen Element Facts. Chemicool. Recuperado de: chemicool.com
- Robert C. Brasted. (09 de julio de 2019). Oxygen: chemical element. Encyclopædia Britannica. Recuperado de: britannica.com
- Wiki Kids. (2019). Oxygen family: properties of VIA elements. Recuperado de: simply.science
- Advameg, Inc. (2019). Oxygen. Recuperado de: madehow.com
- Lenntech B.V. (2019). Periodic table: oxygen. Recuperado de: lenntech.com
- New Jersey Department of Health and Senior Services. (2007). Oxygen: hazardous substance fact sheet. [PDF]. Recuperado de: nj.gov
- Yamel Mattarollo. (26 de agosto de 2015). Aplicaciones industriales del oxígeno industrial. Recuperado de: altecdust.com
