Hidruro de magnesio: estructura, propiedades y usos
El hidruro de magnesio (MgH2 de fórmula molecular), es un compuesto químico con contenido de peso en hidrógeno de un 7.66%, y encontrado en la naturaleza como un sólido cristalino blanco. Es utilizado principalmente para preparar otras sustancias químicas, aunque también ha sido estudiado como un potencial medio de almacenaje para el hidrógeno.
Pertenece a la familia de los hidruros salinos (o iónicos), aquellos definidos por un ión H- cargado negativamente. Estos hidruros se consideran aquellos que se forman a partir de los metales alcalinos y los metales alcalinos térreos, pero en el caso del magnesio (y el berilio) poseen uniones covalentes, además de aquellas iónicas que caracterizan a esta familia de hidruros.
Índice del artículo
- 1 Preparación y fórmula
- 2 Estructura química
- 3 Propiedades del hidruro de magnesio
- 4 Usos/aplicaciones
- 5 Riesgos
- 6 Referencias
El hidruro de magnesio se forma a través de la hidrogenación directa del magnesio (Mg) metálico en condiciones de alta presión y temperatura (200 atmósferas, 500 ºC) con un catalizador MgI2. Su reacción equivale a:
Mg+H2→MgH2
También se ha investigado la producción de MgH2 a menores temperaturas con el uso de magnesio nanocristalino producido en molinos de bola.
Existen también otros métodos de preparación, pero representan reacciones químicas más complejas (hidrogenación del magnesio-antraceno; la reacción entre dietilmagnesio con hidruro litio-aluminio; y como producto de un complejo MgH2).
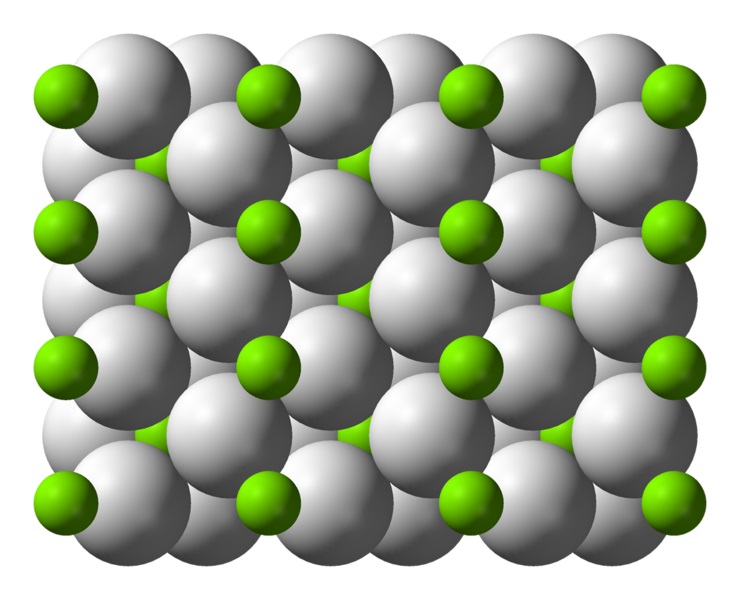
Este átomo posee una estructura de rutilo a temperatura ambiente, con una estructura cristalina tetragonal. Posee al menos cuatro formas distintas en condiciones de alta presión, y además se ha observado una estructura no-estequiométrica con deficiencias de hidrógeno; esta última solo se presenta en cantidades muy pequeñas de partículas al formarse.
Como se mencionó anteriormente, los enlaces que existen en la estructura de rutilo tienen propiedades parcialmente covalentes en lugar de ser puramente iónicos, como otros hidruros salinos.
Esto hace que el átomo de magnesio posea una forma esférica, totalmente ionizada, pero que su ión hidruro sea de estructura alargada.
- Apariencia: Cristales blancos.
- Masa Molar: 26.3209 g/mol
- Densidad: 1.45 g/cm3
- Punto de Fusión: 285°C se descompone
- Solubilidad: En agua se descompone.
Este compuesto químico tiene un peso molecular de 26.321 g/mol, una densidad de 1.45 g/cm³ y posee un punto de fusión de 327 ºC.
- Precursor para la fabricación de otras sustancias químicas.
- Almacenamiento de hidrógeno, como posible fuente de energía.
- Agente reductor en síntesis orgánica.
Es importante indicar que este compuesto no puede ser llevado a estado líquido, y cuando es llevado o su punto de fusión o introducido en agua, se descompone. Este hidruro es insoluble en éter.
Es una sustancia altamente reactiva y sumamente inflamable, y además es pirofórica, es decir, puede inflamarse espontáneamente en el aire. Estas tres condiciones representan riesgos de seguridad que se mencionarán en la última sección de este artículo.
El hidruro de magnesio reacciona fácilmente con agua para formar gas hidrógeno, a través de la siguiente reacción química:
MgH2+2H2O→2H2+Mg(OH)2
Además, esta sustancia se descompone a la temperatura de 287 ºC y presión de 1 bar, de la siguiente manera:
MgH2→Mg+H2
Por lo anterior, se ha propuesto el uso del hidruro de magnesio como medio de almacenamiento de hidrógeno para su uso y transporte.
Se plantea la hidrogenación y deshidrogenación de una cantidad de magnesio metálico como una manera de transportar cantidades de hidrógeno gaseoso, asegurando así que no existan fugas del mismo en su transporte y representando un modo más seguro y práctico que con el uso de recipientes de alta presión.
A pesar de que la temperatura de descomposición del hidruro de magnesio representa una limitante para su uso, se han planteado métodos para mejorar la cinética de las reacciones de hidrogenación y deshidrogenación. Una de estas es con la reducción del tamaño de la partícula de magnesio con la utilización de molinos de bola.
Además, se ha planteado un sistema que produzca un hidruro de magnesio en forma de lodo (más manejable y seguro que aquel en polvo u otras partículas sólidas), el cual se haría reaccionar con agua para la obtención del hidrógeno deseado.
Se estima que el lodo anteriormente nombrado estaría formado por un hidruro finamente molido, protegido con una capa protectora de aceites y suspendido en agentes dispersantes para asegurar que mantenga su consistencia sin pérdidas de material, y que no absorba humedad del ambiente.
Este lodo tiene la ventaja de que puede ser bombeado a través de cualquier bomba común de diesel, gasolina o agua, haciendo esta propuesta económica además de eficiente.
El hidruro de magnesio puede ser implementado en la producción de células avanzadas de combustible, y también en la creación de baterías y almacenamiento de energía.
Durante las últimas décadas, se ha considerado la utilización del hidrógeno como fuente de energía. La implantación del hidrógeno como combustible, requiere encontrar sistemas de almacenamiento segura y reversible y con elevadas capacidades volumétricas (cantidad de hidrógeno por unidad de volumen) y gravimétricas (cantidad de hidrógeno por unidad de masa).
Alquilación (añadir grupos alquilo CH3R) de compuestos orgánicos en medio básico, donde hay presencia de grupos –OH en bajas concentraciones y temperaturas superiores a la del punto de fusión del hidruro.
En este caso los hidrógenos presentes en el hidruro de magnesio (MgH2), se unen a los grupos –OH formando agua. El magnesio libre puede recibir el halógeno que muchas veces viene acompañando a la molécula alquílica que se pretende unir a la cadena hidrocarbonada.
Como ya se mencionó, el hidruro de magnesio es una sustancia que reacciona muy fácil y violentamente con el agua, presentando la capacidad de explotar en concentraciones mayores.
Esto ocurre porque su reacción exotérmica genera el calor suficiente para hacer ignición al gas hidrógeno liberado en la reacción de descomposición, llevando a una reacción en cadena bastante peligrosa.
El hidruro de magnesio también es pirofórico, lo cual quiere decir que puede prenderse en llamas espontáneamente en presencia de aire húmedo, y forma óxido de magnesio y agua.
No es recomendada su inhalación en estado sólido o contacto con sus vapores: la sustancia en estado natural y sus productos de descomposición pueden causar graves heridas o incluso la muerte.
Puede generar soluciones corrosivas en contacto con agua y contaminación de la misma. Contacto con la piel y ojos no es recomendado, y además genera irritación en las mucosas.
No se ha demostrado que el hidruro de magnesio pueda generar efectos crónicos de salud, como por ejemplo el cáncer, defectos reproductivos u otras consecuencias físicas o mentales, pero se recomienda el uso de equipos de protección al manipularlo (especialmente respiradores o mascarillas, por su carácter de fino polvo).
Cuando se trabaje con esta sustancia, debe mantenerse la humedad del aire a niveles bajos, apagar todas fuentes de ignición y transportarlo en tambores u otros recipientes contenedores.
Siempre se debe evitar trabajar con concentraciones grandes de esta sustancia cuando pueda evitarse, ya que la posibilidad de una explosión disminuye significativamente.
De presentarse un derrame del hidruro de magnesio, debe aislarse el área de trabajo y recolectar el polvo con una herramienta aspiradora. Jamás debe usar el método de barrido en seco; incrementa las posibilidades de alguna reacción con el hidruro.
- Zumdahl, S. S. (1998). Encyclopedia Britannica. Tomado de britannica.com.
- PubChem. (2005). PubChem Open Chemistry Database. Tomado de pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Green Car Congress. Tomado de greencarcongress.com.
- Chemicals, C. (n.d.). Cameo Chemicals. Tomado de cameochemicals.noaa.gov.
- Services, N. J. (1987). New Jersey Department of Health and Senior Services. Tomado de nj.gov.
