Ley de Ritchter-Wenzel: historias, enunciados y ejemplos
La ley de Ritchter-Wenzel o de las proporciones recíprocas es aquella que establece que las proporciones másicas entre dos compuestos permiten determinar la de un tercer compuesto. Es una de las leyes de la estequiometría, junto con la ley de Lavoisier (ley de la conservación de la masa); la ley de Proust (ley de las proporciones definidas); y la ley de Dalton (ley de las proporciones múltiples).
Ritcher enunció su ley en 1792 en un libro que definió los fundamentos de la estequiometría, basándose en los trabajos de investigación de Carl F Wenzel, quien en 1777 publicó la primera tabla de equivalencia para ácidos y bases.
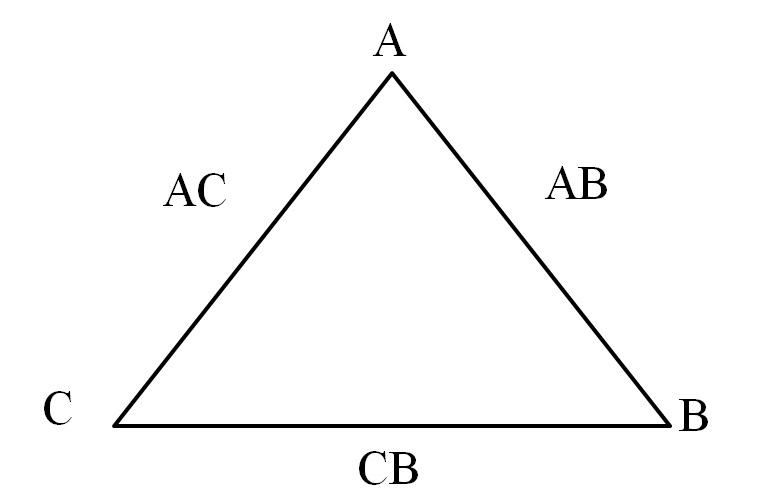
Una manera simple de visualizarla es a través de un “triángulo de reciprocidad” (imagen superior). Si se conocen las masas de A, C y B que se mezclan para formar los compuestos AC y AB, se puede determinar cuánto de C y B se mezclan o reaccionan para formar el compuesto CB.
En los compuestos AC y AB el elemento A está presente en ambos, por lo que al dividir sus proporciones másicas se encuentra cuánto C reacciona con B.
Índice del artículo
- 1 Historia y generalidades de la ley de las proporciones recíprocas
- 2 Enunciados y consecuencias
- 3 Ejemplos
- 4 Referencias
Richter encontró que la proporción en peso de los compuestos consumidos en una reacción química es siempre la misma.
Al respecto, Ritcher halló que se requieren 615 partes en peso de magnesia (MgO), por ejemplo, para neutralizar 1000 partes en peso de ácido sulfúrico.
Entre 1792 y 1794, Ritcher publicó un resumen de tres volúmenes que contenía su trabajo sobre la ley de proporciones definidas. El resumen trataba de la estequiometría, definiéndola como el arte de las mediciones químicas.
Señalando, además, que la estequiometría trata de las leyes según las cuales las sustancias se unen para formar compuestos. Sin embargo, los trabajos de investigación de Richter fueron criticados por el tratamiento matemático que utilizaba, llegándose a señalar que ajustaba sus resultados.
En 1802, Ernst Gottfried Fischer publicó la primera tabla de los equivalentes químicos, que usaba el ácido sulfúrico con la cifra de 1000; semejante al valor hallado por Richter, para la neutralización del ácido sulfúrico por la magnesia.
Sin embargo, se ha señalado que Richter construyó una tabla de pesos de combinación que indicaba la proporción en que reaccionaban un número de compuestos. Por ejemplo, se indica que 859 partes de NaOH neutralizan a 712 partes de HNO3.
El enunciado de la Ley de Richter-Wenzel es el siguiente: las masas de dos elementos diferentes que se combinan con la misma cantidad de un tercer elemento, guardan la misma relación que las masas de aquellos elementos cuando se combinan entre sí.
Esta ley permitió establecer el peso equivalente, o peso-equivalente-gramo, como la cantidad de un elemento o compuesto que reaccionará con una cantidad fija de una sustancia de referencia.
Richter denominó como pesos de combinación relativos a los pesos de los elementos que se combinaban con cada gramo de hidrógeno. Los pesos de combinación relativos de Richter, se corresponden con lo que se conoce actualmente como peso equivalente de los elementos o compuestos.
En concordancia con el planteamiento anterior, la ley de Richter-Wenzel puede ser enunciada de la forma siguiente:
Los pesos de combinación de diferentes elementos que se combinan con un peso determinado de un elemento dado son los pesos de combinación relativos de aquellos elementos cuando se combinan entre sí, o bien múltiplos o submúltiplos de estas relaciones de cantidades.
En el óxido de calcio (CaO), 40 g de calcio se combinan con 16 g de oxígeno (O). Mientras, en el óxido hipocloroso (Cl2O), 71 g de cloro se combinan con 16 g de oxígeno. ¿Qué compuesto formaría el calcio si se combinara con el cloro?
Recurriendo al triángulo de reciprocidad, el oxígeno es el elemento común para los dos compuestos. Se determinan primero las proporciones másicas de los dos compuestos oxigenados:
40g Ca/16 gO= 5g Ca/2g O
71g Cl/16g O
Y ahora dividiendo las dos proporciones másicas de CaO y Cl2O tendremos:
(5g Ca/2g O)/(71g Cl/16g O)= 80g Ca/142g Cl= 40g Ca/71g Cl
Nótese que se cumple la ley de las proporciones másicas: 40 g de calcio reaccionan con 71 g de cloro.
El oxígeno y el azufre reaccionan con cobre para dar óxido de cobre (CuO) y sulfuro de cobre (CuS), respectivamente. ¿Qué cantidad de azufre reaccionaría con oxígeno?
En el óxido de cobre se combinan 63,5 g de cobre con 16 g de oxígeno. En el sulfuro de cobre, 63,5 g de cobre se unen a 32 g de azufre. Dividiendo las proporciones másicas tenemos:
(63,5g Cu/16g O)/(63,5g Cu/32g S)= 2032g S/ 1016g O = 2g S/ 1g O
La proporción másica 2:1 es múltiplo de 4 (63,5/16), lo cual demuestra que se cumple la ley de Richter. Con esta proporción se obtiene el SO, monóxido de azufre (32 g de azufre reaccionan con 16 g de oxígeno).
Si se divide esta proporción entre dos, se tendrá 1:1. Nuevamente, es múltiplo ahora de 4 o 2, y por lo tanto se trata del SO2, dióxido de azufre (32g de azufre reaccionan con 32 g de oxígeno).
Se hace reaccionar sulfuro de hierro (FeS), en el cual se combinan 32 g de azufre con 56 g de hierro, con óxido ferroso (FeO), en el cual se combinan 16 g de oxígeno con 56 g de hierro. Este elemento sirve como referencia.
En los compuestos reaccionantes FeS y FeO, el azufre (S) y el oxígeno (O) con relación al hierro (Fe) se encuentran en la proporción 2:1. En el óxido sulfuroso (SO) se combinan 32 g de azufre con 16 g de oxígeno, por lo que el azufre y el oxígeno se encuentran en la proporción 2:1.
Esto señala que se cumple la ley de las proporciones recíprocas o ley de Richter.
La proporción encontrada entre el azufre y el oxígeno en el oxido sulfuroso (2:1), podría ser utilizada, por ejemplo, para calcular qué cantidad de oxígeno reacciona con 15 g de azufre.
g de oxígeno = (15g de S)∙(1g de O/2g de S)= 7,5g
- Foist L. (2019). Law of Reciprocal Proportion: Definition & Examples. Study. Recuperado de: study.com
- Ciber Tareas. (09 de febrero de 2016). Ley de las proporciones recíprocas o de Richter-Wenzel. Recuperado de: cibertareas.infol
- Wikipedia. (2018). Law of reciprocal proportions. Recuperado de: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter and the law of reciprocal proportions.—II, Annals of Science, 9:4, 289-314, DOI: 10.1080/00033795300200233
- Shrestha B. (18 de junio de 2015). Law of reciprocal proportions. Chemistry Libretexts. Recuperado de: chem.libretexts.org
- Redefining Knowledge. (29 de julio de 2017). Law of reciprocal proportions. Recuperado de: hemantmore.org.in
