Ácido nítrico (HNO3): estructura, propiedades, síntesis y usos
El ácido nítrico es un compuesto inorgánico que consiste de un oxoácido de nitrógeno. Se le considera un ácido fuerte, aunque su pKa (-1,4) es semejante al pKa del ion hidronio (-1,74). Desde este punto, es quizás el “más débil” de muchos ácidos fuertes conocidos.
Su apariencia física consta de un líquido incoloro que por almacenamiento cambia a un color amarillento, debido a la formación de gases nitrogenados. Su fórmula química es HNO3.

Es algo inestable, experimentando una descomposición ligera por la exposición a la luz solar. Además, puede descomponerse completamente por calentamiento, originando dióxido de nitrógeno, agua y oxígeno.
En la imagen superior se muestra un poco de ácido nítrico contenido en un matraz aforado. Puede notarse su coloración amarilla, indicativo de una descomposición parcial.
Se usa en la manufactura de nitratos inorgánicos y orgánicos, así como en compuestos nitrosos que son usados en la fabricación de fertilizantes, explosivos, agentes intermediarios de los tintes y diferentes compuestos químicos orgánicos.
Este ácido era ya conocido por los alquimistas del siglo VIII, al cual denominaban “agua fortis”. El químico alemán Johan Rudolf Glauber (1648) diseñó un método para su preparación, que consistía en el calentamiento de nitrato de potasio con ácido sulfúrico.
Se prepara industrialmente siguiendo el método diseñado por Wilhelm Oswald (1901). El método, en líneas generales, consiste en la oxidación catalítica de amonio, con la generación sucesiva de óxido nítrico y de dióxido de nitrógeno para formar el ácido nítrico.
En la atmósfera, el NO2 producido por la actividad humana reacciona con el agua de las nubes, formando HNO3. Luego, durante las lluvias ácidas, precipita junto con las gotas de agua carcomiendo, por ejemplo, las estatuas de las plazas públicas.
El ácido nítrico es un compuesto muy tóxico, y la exposición continua a sus vapores puede producir bronquitis crónica y una neumonía química.
Índice del artículo
- 1 Estructura del ácido nítrico
- 2 Propiedades físicas y químicas
- 2.1 Nombres químicos
- 2.2 Peso molecular
- 2.3 Aspecto físico
- 2.4 Olor
- 2.5 Punto de ebullición
- 2.6 Punto de fusión
- 2.7 Solubilidad en agua
- 2.8 Densidad
- 2.9 Densidad relativa
- 2.10 Densidad relativa del vapor
- 2.11 Presión de vapor
- 2.12 Descomposición
- 2.13 Viscosidad
- 2.14 Corrosión
- 2.15 Entalpía molar de vaporización
- 2.16 Entalpía molar estándar
- 2.17 Entropía molar estándar
- 2.18 Tensión superficial
- 2.19 Umbral de olor
- 2.20 Constante de disociación
- 2.21 Índice de refracción (η/D)
- 2.22 Reacciones químicas
- 3 Síntesis
- 4 Usos
- 5 Toxicidad
- 6 Referencias

En la imagen superior se muestra la estructura de una molécula de HNO3 con un modelo de esferas y barras. El átomo de nitrógeno, la esfera azul, se ubica en el centro, rodeado de una geometría plano trigonal; sin embargo, el triángulo se halla distorsionado por uno de sus vértices más prolongado.
Las moléculas del ácido nítrico son entonces planas. Los enlaces N=O, N-O y N-OH componen los vértices del triángulo plano. Si se observa detalladamente, el enlace N-OH es más alargado que los otros dos (donde se encuentra la esfera blanca representando al átomo de H).
Hay dos enlaces que tienen la misma longitud: N=O y N-O. Este hecho va en contra de la teoría del enlace de valencia, donde se predice que los dobles enlaces son más cortos que los enlaces simples. La explicación en esto reside en el fenómeno de la resonancia, tal como se observa en la imagen inferior.
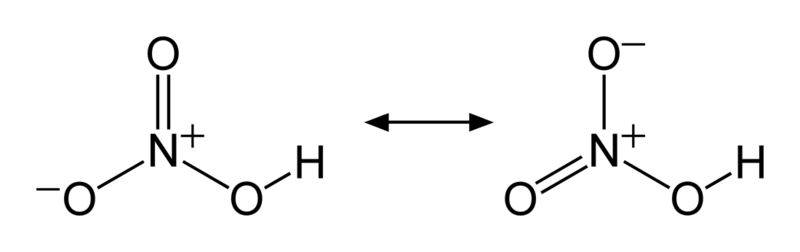
Ambos enlaces, N=O y N-O, son por tanto equivalentes en términos de resonancia. Esto se representa gráficamente en el modelo de la estructura mediante el uso de una línea discontinua entre dos átomos de O (ver estructura).
Cuando se desprotona el HNO3, se forma el anión estable nitrato NO3–. En él, la resonancia involucra ahora los tres átomos de O. Esta es la razón de por qué el HNO3 tiene una gran acidez de Bronsted-Lowry (especie donadora de iones H+).
-Ácido nítrico
-Ácido azótico
-Nitrato de hidrógeno
-Agua fortis.
63,012 g/mol.
Líquido incoloro o de un color amarillo pálido, que puede tornarse a marrón rojizo.
Acre, asfixiante característico.
181 ºF a 760 mmHg (83 ºC).
-41,6 ºC.
Muy soluble y miscible con agua.
1,513 g/cm3 a 20 ºC.
1,50 (en relación al agua=1).
2 o 3 veces estimada (en relación al aire=1).
63,1 mmHg a 25 ºC.
Por exposición a la humedad atmosférica o calor puede descomponerse formando peróxido de nitrógeno. Cuando se calienta este a descomposición, emite un humo muy tóxico de óxido de nitrógeno y nitrato de hidrógeno.
El ácido nítrico no es estable, pudiéndose descomponer en contacto con el calor y exposición a la luz solar, y emitiendo dióxido de nitrógeno, oxígeno y agua.
1,092 mPa a 0 ºC, y 0,617 mPa a 40 ºC.
Es capaz de atacar a todos los metales básicos, exceptuando el aluminio y al acero crómico. Ataca algunas de las variedades del material plástico, cauchos y revestimientos. Es una sustancia cáustica y corrosiva, por lo que debe manipularse con suma precaución.
39,1 kJ/mol a 25 ºC.
-207 kJ/mol (298 ºF).
146 kJ/mol (298 ºF).
-0,04356 N/m a 0 ºC
-0,04115 N/m a 20 ºC
-0,0376 N/m a 40 ºC
-Olor bajo: 0,75 mg/m3
-Olor alto: 250 mg/m3
-Concentración irritante: 155 mg/m3.
pKa = -1,38.
1,393 (16,5 ºC).
Hidratación
-Puede formar hidratos sólidos, como HNO3∙H2O y HNO3∙3H2O: “hielos nítricos”.
Disociación en agua
El ácido nítrico es un ácido fuerte que se ioniza rápidamente en agua en la forma siguiente:
HNO3 (l) + H2O (l) => H3O+ (ac) + NO3–
Formación de sales
Reacciona con óxidos básicos formando una sal de nitrato y agua.
CaO (s) + 2 HNO3 (l) => Ca(NO3)2 (ac) + H2O (l)
Igualmente, reacciona con las bases (hidróxidos), formando una sal de nitrato y agua.
NaOH (ac) + HNO3 (l) => NaNO3 (ac) + H2O (l)
Y también con los carbonatos y los carbonatos ácidos (bicarbonatos), formando además dióxido de carbono.
Na2CO3 (ac) + HNO3 (l) => NaNO3 (ac) + H2O (l) + CO2 (g)
Protonación
El ácido nítrico puede comportarse también como una base. Por esta razón, puede reaccionar con el ácido sulfúrico.
HNO3 + 2H2SO4 => NO2+ + H3O+ + 2HSO4–
Autoprotólisis
El ácido nítrico experimenta una autoprotólisis.
2HNO3 => NO2+ + NO3– + H2O
Oxidación de metales
En la reacción con los metales el ácido nítrico no se comporta como los ácidos fuertes, los cuales reaccionan con los metales formando la sal correspondiente y liberando hidrógeno en forma gaseosa.
Sin embargo, el magnesio y el manganeso reaccionan en caliente con el ácido nítrico, tal como lo hacen los restantes ácidos fuertes.
Mg (s) + 2 HNO3 (l) => Mg(NO3)2 (ac) + H2 (g)
Otras
El ácido nítrico reacciona con los sulfitos metálicos originando una sal de nitrato, dióxido de azufre y agua.
Na2SO3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SO2 (g) + H2O (l)
Y además reacciona con los compuestos orgánicos, sustituyendo un hidrógeno por un grupo nitro; constituyendo así la base para la síntesis de compuestos explosivos como la nitroglicerina y el trinitrotolueno (TNT).
Se produce a nivel industrial mediante la oxidación catalítica de amonio, según el método descrito por Oswald en 1901. El procedimiento consta de tres etapas o pasos.
Etapa 1: Oxidación de amonio a óxido nítrico
El amonio es oxidado por el oxígeno presente en el aire. La reacción se realiza a 800 ºC y a unapresión de 6-7 atm, con el uso de platino como catalizador. El amonio se mezcla con el aire con la proporción siguiente: 1 volumen de amonio por 8 volúmenes de aire.
4NH3 (g) + 5O2 (g) => 4NO (g) + 6H2O (l)
En la reacción se origina óxido nítrico, el cual es llevado a la cámara de oxidación para la etapa siguiente.
Etapa 2. Oxidación de óxido nítrico en dióxido de nitrógeno
La oxidación es realizada por el oxígeno presente en el aire a una temperatura inferior a 100 ºC.
2NO (g) + O2 (g) => 2NO2 (g)
Etapa 3. Disolución del dióxido de nitrógeno en agua
En esta etapa ocurre la formación del ácido nítrico.
4NO2 + 2H2O + O2 => 4HNO3
Hay varios métodos para la absorción de dióxido de nitrógeno (NO2) en agua.
Entre otros métodos: el NO2 es dimerizado a N2O4 a bajas temperaturas y alta presión, con el fin de aumentar su solubilidad en el agua y producir ácido nítrico.
3N2O4 + 2H2O => 4HNO3 + 2NO
El ácido nítrico producido por la oxidación de amonio tiene una concentración comprendida entre 50-70%, la cual puede ser llevada a 98% mediante el uso del ácido sulfúrico concentrado como deshidratante, permitiendo aumentar la concentración del ácido nítrico.
Descomposición térmica del nitrato de cobre (II), produciendo los gases dióxido de nitrógeno y oxígeno, los cuales son pasados a través del agua para formar el ácido nítrico; tal como ocurre en el método de Oswald, anteriormente descrito.
2Cu(NO3)2 => 2CuO + 4NO2 + O2
Reacción de una sal de nitrato con H2SO4 concentrado. El ácido nítrico formado es separado del H2SO4 mediante destilación a 83 ºC (punto de ebullición del ácido nítrico).
KNO3 + H2SO4 => HNO3 + KHSO4
El 60% de la producción de ácido nítrico es utilizada en la fabricación de fertilizantes, especialmente nitrato de amonio.
Este se caracteriza por su alta concentración de nitrógeno, uno de los tres nutrientes principales de las plantas, utilizándose el nitrato inmediatamente por las plantas. Mientras, el amonio es oxidado por los microorganismos presentes en el suelo, y es utilizado como abono a largo plazo.
-El 15 % de la producción de ácido nítrico se emplea en la manufactura de fibras sintéticas.
-Se emplea en elaboración de ésteres de ácido nítrico y nitroderivados; tales como nitrocelulosa, pinturas acrílicas, nitrobenceno, nitrotolueno, acrilonitrilos, etc.
-Puede adicionar grupos nitro a compuestos orgánicos, pudiéndose utilizar esta propiedad para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT).
-El ácido adípico, un precursor del nylon, es producido a gran escala mediante la oxidación de la ciclohexanona y ciclohexanol por el ácido nítrico.
El ácido nítrico debido a su capacidad oxidante, es muy útil en la purificación de metales presentes en los minerales. Asimismo, es empleado en la obtención de elementos como el uranio, el manganeso, el niobio, el circonio, y en la acidificación de las rocas fosfóricas para obtener ácido fosfórico.
Se mezcla con el ácido clorhídrico concentrado para formar “el agua regia”. Esta disolución es capaz de disolver el oro y platino, lo que permite su uso en la purificación de estos metales.
El ácido nítrico es empleado para obtener un efecto de antigüedad en los muebles elaborados con madera de pino. El tratamiento con una solución de ácido nítrico al 10% produce una coloración gris-oro en la madera de los muebles.
-La mezcla de soluciones acuosas de ácido nítrico 5-30% y ácido fosfórico 15-40% se emplea en la limpieza del equipo utilizado en la labores de ordeño, con el fin de eliminar los residuos de los precipitados de los compuestos de magnesio y calcio.
-Es útil en la limpieza del material de vidrio empleado en el laboratorio.
-El ácido nítrico se ha usado en la fotografía, específicamente como aditivo para los reveladores de sulfato ferroso en el proceso de la placa húmeda, con el objetivo de promover un color más blanco en los ambrotipos y ferrotipos.
-Se utilizó para disminuir el pH del baño de plata de las placas de colodión, lo que permitió obtener una reducción en la aparición de una niebla que interfería con las imágenes.
-Debido a su capacidad disolvente, se utiliza en el análisis de diferentes metales mediante las técnicas de espectrofotometría de absorción atómica de llama, y la espectrofotometría de masa de plasma de acoplamiento inductivo.
-La combinación de ácido nítrico y ácido sulfúrico se utilizó para la conversión de algodón común en nitrato de celulosa (algodón nítrico).
-El medicamento Salcoderm de uso externo, es empleado en el tratamiento de neoplasmas benignos de la piel (verrugas, callos, condilomas y papilomas). Posee propiedades de cauterización, alivio del dolor, la irritación y la picazón. El ácido nítrico es el componente principal de la fórmula del medicamento.
-El ácido nítrico fumante rojo, y el ácido nítrico fumante blanco, son utilizados como oxidantes para los combustibles líquidos de cohetes, especialmente en el misil BOMARC.
-En contacto con la piel puede provocar quemaduras en la piel, dolor intenso y dermatitis.
-En contacto con los ojos puede causar dolor intenso, lagrimeo y en casos graves, daño de la córnea y ceguera.
-La inhalación de los vapores puede causar tos, dificultad respiratoria, ocasionando en exposiciones intensas o crónicas sangrado de la nariz, laringitis, bronquitis crónica, neumonía y edema pulmonar.
-Por su ingestión se produce lesiones en la boca, salivación, sed intensa, dolor para tragar, dolores intensos en todo el tracto digestivo y riesgo de perforación de la pared del mismo.
- Wikipedia. (2018). Nitric acid. Recuperado de: en.wikipedia.org
- PubChem. (2018). Nitric acid. Recuperado de: pubchem.ncbi.nlm.nih.gov
- The Editors of Encyclopaedia Britannica. (23 de noviembre de 2018). Nitric acid. Encyclopædia Britannica. Recuperado de: britannica.com
- Shrestha B. (s.f.). Properties of nitric acid and uses. Chem Guide: tutorials for chemistry learning. Recuperado de: chem-guide.blogspot.com
- Chemical Book. (2017). Nitric acid. Recuperado de: chemicalbook.com
- Imanol. (10 de septiembre de 2013). Producción de ácido nítrico. Recuperado de: ingenieriaquimica.net
