Hidróxido de sodio (NaOH): estructura, propiedades, usos, síntesis
El hidróxido de sodio es un compuesto inorgánico cuya fórmula química es NaOH y consiste de una base o álcali metálica muy fuerte. Una solución al 5 % de la misma en agua tiene un pH cercano a 14.
Es un sólido blanco muy higroscópico y que además, puede absorber dióxido de carbono del aire para formar carbonato de sodio. Comercialmente viene en botellas de plástico como pastillas, las cuales no pueden estar expuestas demasiado tiempo al aire, ni deben tampoco manipularse con espátulas.

El hidróxido de sodio puede sintetizarse al reaccionar hidróxido de calcio con carbonato de sodio. Actualmente sin embargo, se sintetiza fundamentalmente mediante la electrólisis de la salmuera, y es un producto secundario de la producción del cloro gaseoso.
Dada la alta basicidad del NaOH tiene numerosos usos y aplicaciones, tal como la producción de papel, jabones, detergentes, tintes, etc. Asimismo se usa en la limpieza del hogar, el tratamiento del agua, el procesamiento del aluminio, la fabricación de medicinas, etc.; y sobre todo, es un patrón secundario por excelencia.
El hidróxido de sodio es muy corrosivo, siendo capaz de producir irritación y quemaduras en la piel y en los ojos. Por inhalación de su polvo, puede provocar edema pulmonar. Mientras, su ingestión puede producir lesiones tan graves en el tracto digestivo que puede llevar a la muerte.
Índice del artículo
- 1 Estructura
- 2 Propiedades físicas y químicas
- 2.1 Nombres
- 2.2 Masa molar
- 2.3 Apariencia
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Solubilidad en agua
- 2.7 Basicidad (pKb)
- 2.8 pH
- 2.9 Índice de refracción (nD)
- 2.10 Estabilidad
- 2.11 Descomposición
- 2.12 Punto de auto-ignición
- 2.13 Viscosidad
- 2.14 Calor de vaporización
- 2.15 Tensión superficial
- 2.16 Reactividad
- 3 Síntesis
- 4 Usos
- 5 Riesgos
- 6 Referencias

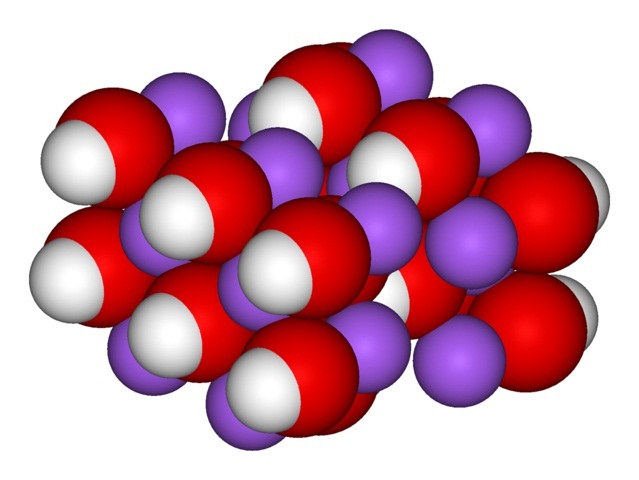
En la imagen superior se muestran los iones que componen al NaOH. El catión Na+ viene representado por la esfera morada, mientras que el anión hidroxilo (hidróxido u oxidrilo) OH– por la esfera roja y blanca. Ambos iones Na+ y OH– interaccionan mutuamente mediante la atracción electrostática de sus cargas opuestas.
Tales interacciones son no direccionales, por lo que las atracciones de un par iónico Na+OH– puede afectar las de otros a una cierta distancia. El resultado es que los iones Na+ se repelen entre sí, de igual modo que los OH–, hasta definir un cristal de mínima energía donde establecen una estructura ordenada y periódica (cristalina).
Aparece por tanto los cristales ortorrómbicos de NaOH anhidro (sin agua):
Los iones se mantienen lo suficientemente cohesionados para que el cristal anhidro del NaOH fundan a 323 ºC (siempre que no haya humedad en el entorno).
Tanto el Na+ como el OH– son iones que las moléculas de agua solvatan (hidratan) con facilidad. Esto favorece su hidratación por encima de la energía reticular de sus cristales, por lo que el NaOH libera mucha energía cuando entra en contacto con el agua.
No obstante, los cristales anhidros pueden hospedar moléculas de agua sin disolverse; esto es, el hidróxido de sodio puede formar numerosos hidratos, NaOH·nH2O. La molécula de agua puede bien formar un puente de hidrógeno con el OH– (HOH—OH–), o coordinarse con el Na+ (Na+—OH2).
Dependiendo de la proporción molar entre NaOH y H2O, pueden surgir monohidratos (NaOH·H2O), dihidratos (NaOH·2H2O), trihemidratos (NaOH·3.5H2O), tetrahidratos (NaOH·4H2O), heptahidratos (NaOH·7H2O), y otros más.
Cada uno estos hidratos pueden cristalizar desde una disolución acuosa de NaOH con diferentes porcentajes másicos y a distintas temperaturas. En consecuencia, el NaOH exhibe un complicado diagrama de solubilidad en el agua.
En términos generales los cristales de los hidratos son menos densos y tienen puntos de fusión inferiores. Esto se debe a que las moléculas de agua “entorpecen” las interacciones entre el Na+ y OH–, agregando fuerzas dipolo-dipolo en sacrificio de las atracciones iónicas.
Nombre preferido IUPAC: hidróxido de sodio. Otros nombres: Soda cáustica, ascarita (menos común)
39,9971 g/mol
Sólido o cristales blancos, serosos u opacos.
323 ºC
1.388 ºC
1.000 g/L a una temperatura de 25 ºC. Esto demuestra lo mucho que puede disolverse en agua.
Sus disoluciones acuosas son viscosas, con un valor de viscosidad cerca de ochenta veces mayor que la del agua, y liberan mucho calor al principio. Si se tiene contacto con ellas tornan la piel resbaladiza, debido a la saponificación de los ácidos grasos de la piel.
– 0,56
Una solución al 5 % p/p en agua tiene un pH cercano a 14
A una longitud de onda de 580,4 nm: 1,433 a 320 ºC, y 1,421 a 420 ºC.
Los recipientes que lo contienen deben estar herméticamente cerrados para prevenir la formación del carbonato de sodio. Esto se debe a su alta higroscopicidad, la cual lo lleva a absorber la humedad de su entorno y su contenido de CO2.
Cuando se calienta a descomposición emite un humo de óxido de sodio.
No es inflamable
4,0 cPoise a 350 ºC
175 kJ/mol a 1.388 ºC
74,35 dinas/cm en una solución al 2,72 % p/p en agua a 18 ºC.
Con los ácidos
Reacciona con los ácidos minerales orgánicos e inorgánicos, originando agua y la sal correspondiente. En el caso del ácido sulfúrico la reacción es exotérmica.
2 NaOH + H2SO4 => Na2SO4 + 2 H2O
Con los óxidos ácidos
Reacciona con el dióxido de azufre, por ejemplo, dando una sal de sulfito de y agua:
2 NaOH + SO2 => Na2SO3 + H2O
Con los metales
Sus disoluciones acuosas reaccionan con algunos metales para originar sales complejas de sodio. Por ejemplo, su reacción con el zinc da lugar a un zincato de sodio:
Zn + 2 NaOH + 2 H2O => Na2[Zn(OH)4] + H2
El hidróxido de sodio se sintetiza principalmente por dos métodos: el uso del carbonato de sodio, empleado inicialmente, y la electrólisis del cloruro de sodio, actualmente de mayor uso industrial.
El carbonato de sodio reacciona con el hidróxido de calcio en un proceso conocido como caustificación:
Ca(OH)2 + Na2CO3 => CaCO3 + NaOH
El carbonato de calcio precipita, quedando en el sobrenadante el hidróxido de sodio, el cual se concentra por evaporación.
El carbonato de sodio proviene previamente del proceso Solvay:
2 NaCl + CaCO3 => Na2CO3 + CaCl2
La electrólisis del cloruro de sodio, presente en la salmuera, produce gas hidrógeno, gas cloruro e hidróxido de sodio en solución acuosa:
2 Nacl + 2 H2O => H2 + Cl2 + 2 NaOH
La cámara electrolítica consta de un compartimiento donde está el ánodo (+), de metal titanio, y sitio donde se coloca la salmuera. Este compartimiento está separado del compartimiento del cátodo (-) mediante una membrana porosa.
En el ánodo se produce la reacción siguiente:
2 Cl– => Cl2 + 2 e– (oxidación)
Mientras, en el cátodo se produce esta reacción:
2 H2O + 2 e– => H2 + OH– (reducción)
El sodio (Na+) difunde del compartimiento del ánodo al del cátodo, a través de la membrana que los separa, formándose el hidróxido de sodio.
El hidróxido de sodio se usa para la fabricación de jabones y detergentes usados en el hogar y en la actividad comercial. La combinación de hidróxido de sodio y cloro produce el blanqueador de cloro, empleado en lavado de la ropa blanca.
Asimismo elimina la acumulación de grasa en los desagües, produciendo su eliminación mediante su conversión en jabones a través del proceso de saponificación. Esto permite la eliminación de la obstrucción de las cañerías de los hogares y otras edificaciones.
El hidróxido de sodio se emplea en la elaboración de analgésicos comunes, tal como la aspirina. También de fármacos con acción anticoagulante que bloquean la formación de coágulos sanguíneos y medicamentos para reducir la hipercolesterolemia.
El hidróxido de sodio se usa en la fabricación de celdas de combustibles que funcionan como baterías para producir electricidad para una variedad de aplicaciones, incluyendo el transporte. Las resinas epoxi, fabricadas con la intervención del hidróxido de sodio, se usa en las turbinas eólicas.
El hidróxido de sodio se emplea para neutralizar la acidez del agua y contribuir a la eliminación de los metales pesados de la misma. También se usa para la producción del hipoclorito de sodio, un desinfectante del agua.
El hidróxido de sodio se hace reaccionar con el sulfato de aluminio para la formación del hidróxido de aluminio: agente floculante que se usa en la plantas de tratamiento de agua para incrementar la sedimentación de partículas, produciendo su clarificación.
El hidróxido de sodio se utiliza con el sulfuro de sodio en el tratamiento de la madera para la obtención de la celulosa, en una forma casi pura, la cual forma la base del papel. Asimismo se emplea en el reciclaje del papel, ya que al ayudar a separar la tinta, permite usarlo de nuevo.
El hidróxido de sodio se emplea en la fabricación de rayón, spandex, explosivos, resinas epoxi, vidrios y cerámica. Se usa en la industria textil para hacer tintes, y procesar tejidos de algodón.
En las plantas de tratamiento de la caña de azúcar, se usa el hidróxido de sodio a baja temperatura para la producción de etanol del bagazo de la caña de azúcar.
El hidróxido de sodio es un compuesto altamente corrosivo, por lo que puede provocar, por contacto con la piel, quemaduras, ampollas y hasta cicatrices permanentes.
En contacto con los ojos, puede producir quemaduras graves, hinchazón, dolor, visión borrosa, y en casos severos, puede ocasionar la ceguera permanente.
La ingestión del hidróxido de sodio puede producir quemaduras en los labios, lengua, garganta, esófago y estómago. Entre los síntomas usuales, se manifiestan náuseas, vómitos, calambres estomacales y diarrea.
Aunque la inhalación de hidróxido de sodio es poco frecuente, y solo puede ocurrir por la presencia de polvo del compuesto en el aire o por la formación de un rocío que lo contenga, produce una irritación en los pulmones.
En el caso de una exposición crónica, esta puede ocasionar edema pulmonar y acortamiento severo de la respiración, lo cual constituye una emergencia médica.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Sodium hydroxide. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Sodium hydroxide. PubChem Database. CID=14798. Recuperado de: pubchem.ncbi.nlm.nih.gov
- American Elements. (2019). Sodium hydroxide solution. Recuperado de: americanelements.com
- Chemical Safety facts. (2019). Sodium hydroxide. Recuperado de: chemicalsafetyfacts.org
- NJ Health. (2015). Sodium hydroxide. [PDF]. Recuperado de: nj.gov
- Canadian Centre for Occupational Health & Safety. (2019). OSH Answers Fact Sheets: sodium hydroxide. Recuperado de: ccohs.ca
- Ausetute. (s.f.). Sodium Hydroxide and Chlorine Production by Electrolysis. Recuperado de: ausetute.com.au
