Peso equivalente: qué es, fórmula, para qué sirve, cálculo, ejemplos
¿Qué es el peso equivalente?
El peso equivalente es el peso o la masa de un equivalente de sustancia. Es decir, es el peso o la masa de una sustancia que equivale químicamente a 1 mol de otra sustancia del mismo tipo que se utiliza como patrón de referencia y se considera normal.
La sustancia normal que se toma como referencia depende del tipo de reacción química involucrada y del papel que el compuesto juegue en dicha reacción. Los compuestos normales siempre reaccionan entre sí con estequiometría 1:1.
Por ejemplo, si hablamos de una reacción ácido/base, el peso equivalente de un ácido sería el peso de dicho compuesto que equivale a 1 mol de un ácido normal, el cual es aquel que posee un solo protón ionizable.
Antes de que se supiera que la materia estaba formada por átomos y moléculas, se habían establecido ya una serie de leyes que determinaban la relación en masa (o en peso) entre los reactivos y productos de una reacción química.
Estas leyes formaron las bases de los cálculos estequiométricos durante los inicios de la química como ciencia.
El concepto de peso equivalente está relacionado con esta etapa temprana del desarrollo de la química. A continuación, discutiremos cómo se calcula, para qué sirve y algunos ejemplos comunes de su cálculo.
Fórmula y unidades del peso equivalente
El peso equivalente se calcula a partir del peso molecular de una sustancia por medio de la siguiente fórmula:
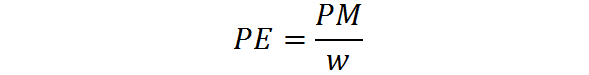
Donde PE es el peso equivalente, PM es el peso molecular o la masa molar de la sustancia, y w representa el número de equivalentes por mol.
Este último consiste siempre en un número entero igual o mayor que 1. Representa el número de moléculas de un reactivo “normal” a las que equivale cada molécula de la sustancia. Por lo tanto, depende del tipo de reactivo del que se trate y del tipo de reacción química involucrada.
También se puede calcular a partir de la masa, m, y el número de equivalentes:
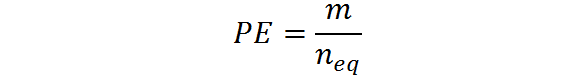
Unidades del peso equivalente
Como se puede ver de la fórmula anterior, el peso equivalente se expresa en unidades de masa (por lo general gramos) sobre número de equivalentes. Es decir, las unidades son g/eq.
El valor de w en la primera fórmula anterior viene expresado en unidades de equivalentes sobre mol (eq/mol), mientras que la masa molar se expresa en gramos sobre mol (g/mol).
¿Para qué sirve el peso equivalente?
La utilidad principal del peso equivalente es que simplifica los cálculos estequiométricos. El peso equivalente de una sustancia equivale al peso equivalente de otra sustancia del mismo tipo y para la misma clase de reacción química. De hecho, de allí obtiene su nombre.
Esto nos permite llevar a cabo cálculos estequiométricos de manera muy sencilla y sin la necesidad de escribir y balancear ecuaciones químicas.
¿Cómo se calcula el peso equivalente?
Como vimos antes, el peso equivalente se calcula a partir del peso molecular y el número de equivalentes por mol o w.
Cálculo del peso molecular
El peso molecular de una sustancia se determina sumando el peso atómico de todos los átomos que la conforman. Estos pesos atómicos los encontramos en la tabla periódica.
Determinación de w
El valor de w para una sustancia depende del tipo de reacción en la que está involucrada. Es decir, depende del tipo de reactivo del que se trate. Para cada tipo de sustancia existe una manera distinta de determinar w.
La siguiente tabla muestra cómo se determina w para distintos casos.
| Tipo de reactivo | Valor de w |
| Ácidos | Número de hidrógenos ionizables por cada molécula del ácido. |
| Bases | Número de protones que puede captar o neutralizar cada molécula de la base. |
| Agentes oxidantes | Número de electrones que capta cada mol de agente oxidante en la semirreacción de reducción. |
| Agentes reductores | Número de electrones que libera cada mol de agente reductor en la semirreacción de oxidación. |
| Sales | Número total de cargas positivas o negativas que se generan al ionizarse un mol de la sal. |
| Sustancias neutras | 1 |
Cabe destacar que, si una sustancia puede participar en más de un tipo de reacción química, podrá tener más de un valor de w y, por lo tanto, más de un peso equivalente.
Importancia y aplicaciones del peso equivalente
El peso equivalente se utiliza para calcular el número de equivalentes de una sustancia química. Este número de equivalentes es siempre igual al número de equivalentes de otra sustancia con la cual reacciona.
Esto se utiliza principalmente en dos ámbitos diferentes:
En química analítica
Los equivalentes se utilizan a menudo para facilitar cálculos estequiométricos en química analítica. Esto es particularmente cierto en el caso del análisis volumétrico y gravimétrico.
El conocimiento del volumen de la titulación en el punto de equivalencia y la concentración del titulante, así como el peso equivalente del titulado, permiten fácilmente calcular la masa del analito presente en una muestra.
En electrólisis
En el campo de la electrólisis, el peso equivalente representa el peso de un metal u otra sustancia que se puede producir al pasar 96.500 C de carga a través de la celda electrolítica. Esto facilita los cálculos estequiométricos y económicos del proceso de electrólisis.
Ejemplos del cálculo del peso equivalente
Calcio
El peso atómico del calcio es 40 y este metal forma cationes con valencia +2, por lo que su peso equivalente es 40/2 = 20 g/eq.
Ácido sulfúrico (H2SO4)
El peso molecular de este compuesto es 98 y es un ácido diprótico, por lo que w = 2. Por lo tanto, el peso equivalente es PE: 98/2 = 49 g/eq.
Hidróxido de aluminio (Al(OH)3)
El hidróxido de aluminio (PM = 78) es un compuesto anfótero que puede actuar como ácido y como base.
Si actúa como base liberando sus tres hidróxidos, entonces w = 3, así que PE: 78/3 = 26 g/eq. En cambio, cuando actúa como ácido, capta una molécula de agua y libera un protón, por lo que, en este caso, w = 1 y PE = 78 g/eq.
Fosfato de calcio (Ca3(PO4)2)
El fosfato de calcio es una sal que, al disociarse, produce 3 iones Ca2+ y 2 iones PO43-.
En cualquiera de los casos, el número de cargas del mismo signo que produce cada unidad de fosfato de calcio es 6, así que w = 6 y PE = 310/6 = 51,67 g/eq.
Referencias
- Enciclopedia Universal (s. f.). Peso equivalente. Tomado de enciclopedia_universal.es-academic.com.
- Química, Química Inorgánica (s. f.). Peso Equivalente. Tomado de fullquimica.com.
- Química.ES (s. f.). Equivalente. Tomado de quimica.es.
- Spiegato (2021). ¿Qué es el peso equivalente? Tomado de spiegato.com.
