Metales
Te explicamos qué son los metales, cómo se clasifican y cuáles son sus propiedades físicas. Ejemplos de metales y cuáles son los no metales.

¿Qué son los metales?
En el ámbito de la química, se conocen como metales o metálicos a aquellos elementos de la Tabla Periódica que se caracterizan por ser buenos conductores de la electricidad y del calor. Estos elementos tienen altas densidades y son generalmente sólidos a temperatura ambiente (excepto el mercurio). Muchos, además, pueden reflejar la luz, lo cual les otorga su brillo característico.
Los metales son los elementos más numerosos de la Tabla Periódica y algunos forman parte de los más abundantes de la corteza terrestre. Una parte de ellos suele hallarse en estado de mayor o menor pureza en la naturaleza, aunque la mayoría forma parte de minerales del subsuelo terrestre y deben ser separados por el ser humano para utilizarlos.
Los metales presentan enlaces característicos llamados “enlaces metálicos”. En este tipo de enlace los átomos metálicos se encuentran unidos entre sí de forma que sus núcleos atómicos se juntan con los electrones de valencia (electrones ubicados en la última capa electrónica, es decir, electrones más externos), que forman una especie de “nube” a su alrededor. Así, en el enlace metálico, los átomos metálicos están ubicados unos muy cerca de otros, y todos están “inmersos” en sus electrones de valencia, formando la estructura metálica.
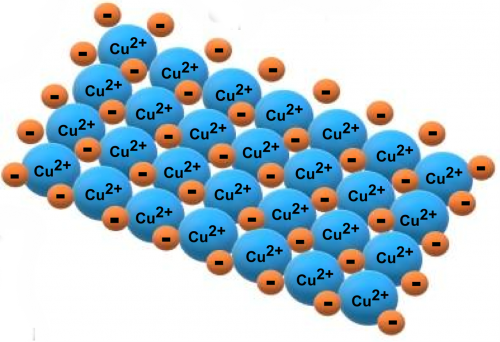
Por otra parte, los metales pueden formar enlaces iónicos con no metales (por ejemplo, cloro y flúor), lo que da lugar a la formación de sales. Este tipo de enlace se forma por la atracción electrostática entre iones de distinto signo, donde los metales forman los iones positivos (cationes) y los no metales forman los iones negativos (aniones). Cuando estas sales se disuelven en agua, se disocian en sus iones.
Incluso las aleaciones de un metal con otro (o con un no metal) continúan siendo materiales metálicos, como es el caso del acero y el bronce, aunque sean mezclas homogéneas.
Los metales han servido a la humanidad desde tiempos inmemoriales gracias a su carácter idóneo para formar herramientas, estatuas o estructuras de todo tipo, debido a sus particulares propiedades físicas:
- Maleabilidad. Al someterse a compresión, algunos metales pueden formar láminas delgadas de material homogéneo.
- Ductilidad. Al ser sometidos a fuerzas de tracción, algunos metales pueden formar alambres o hilos de material homogéneo.
- Tenacidad. Capacidad de resistirse a la fractura, cuando se les somete a fuerzas bruscas (golpes, caídas, etc.).
- Resistencia mecánica. Capacidad de soportar tracción, compresión, torción y otras fuerzas sin ceder en su estructura física ni deformarse.
Además, su brillo los hace idóneos para forjar joyas y elementos decorativos y su buena conducción de la electricidad los hace indispensables en la transmisión de la corriente eléctrica en los sistemas modernos de energía eléctrica.
Ver también: Conductividad eléctrica
Tipos de metales

Los elementos metálicos pueden ser de diversos tipos, según los cuales se agrupan en la Tabla Periódica. Cada grupo tiene propiedades compartidas:
- Metales alcalinos. Son brillantes, blandos y muy reactivos en condiciones normales de presión y temperatura (1 atm y 25º C), por lo que nunca están puros en la naturaleza. Tienen bajas densidades y son buenos conductores del calor y la electricidad. También tienen bajos puntos de fusión y ebullición. En la Tabla Periódica ocupan el grupo I (1). En este grupo además se encuentra el hidrógeno (que no es un metal).
- Metales alcalinotérreos. Están situados en el grupo II (2) de la Tabla Periódica. Su nombre proviene de las propiedades alcalinas de sus óxidos (llamados “tierras” antiguamente). Suelen ser más duros y menos reactivos que los alcalinos. Son brillantes y buenos conductores del calor y la electricidad. Tienen baja densidad y color.
- Metales de transición. La mayoría de los metales pertenecen a esa categoría. Ocupan la región central de la Tabla Periódica y casi todos son duros, con elevados puntos de fusión y ebullición, y buena conducción del calor y la electricidad.
- Lantánidos. También llamados lantanoides, son las llamadas “tierras raras” de la Tabla Periódica, que con los actínidos forman los “elementos de transición interna”. Son elementos muy similares entre sí, y a pesar de su nombre, son muy abundantes en la superficie terrestre. Tienen comportamientos magnéticos (cuando interactúan con un campo magnético, por ejemplo, el campo magnético que genera un imán) y espectrales (cuando la radiación incide sobre ellos) muy característicos.
- Actínidos. Junto a las tierras raras, forman los “elementos de transición interna”, y son muy similares entre sí. Presentan altos números atómicos y muchos de ellos son radiactivos en todos sus isótopos, lo que hace que sean sumamente escasos en la naturaleza.
- Transactínidos. También llamados “elementos superpesados”, son aquellos que superan en número atómico al más pesado de los actínidos, el lawrencio (103). Todos los isótopos de estos elementos tienen una vida media muy corta, son todos radiactivos y se han obtenido por síntesis en un laboratorio, por lo que poseen los nombres de los físicos responsables de su creación.
Ejemplos de metales

- Alcalinos. Litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs), francio (Fr).
- Alcalinotérreos. Berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra).
- Metales de transición. Escandio (Sc), titanio (Ti), vanadio (V), cromo (Cr), manganeso (Mn), hierro (Fe), cobalto (Co), níquel (Ni), cobre (Cu), zinc (Zn), itrio (Y), circonio (Zr), niobio (Nb), molibdeno (Mo), tecnecio (Tc), rutenio (Ru), rodio (Rh), paladio (Pd), plata (Ag), cadmio (Cd), lutecio (Lu), hafnio (Hf), tántalo (Ta), wolframio (W), renio (Re), osmio (Os), iridio (Ir), platino (Pd), oro (Au), mercurio (Hg), lawrencio (Lr), rutherfordio (Rf), dubnio (Db), seaborgio (Sg), bohrio (Bh), hasio (Hs), meitnerio (Mt), darmstadio (Ds), roentgenio (Rg), copernicio (Cn).
- Tierras raras. Lantano (La), cerio (Ce), praseodimio (Pr), neodimio (Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd), terbio (Tb), disprosio (Dy), holmio (Ho), erbio (Er), tulio (Tm), Iterbio (Yb), lutecio (Lu).
- Actínidos. Actinio (Ac), torio (Th), protactinio (Pa), uranio (U), neptunio (Np), plutonio (Pu), americio (Am), curio (Cm), berkelio (Bk), californio (Cf), einstenio (Es), fermio (Fm), mendelevio (Md), nobelio (No), lawrencio (Lr).
- Transactínidos. Rutherfordio (Rf), dubnio (Db), seaborgio (Sg), bohrio (Bh), hassio (Hs), meitnerio (Mt), darmstadio (Ds), roentgenio (Rg), copernicio (Cn), nihonio (Nh), flerovio (Fl), moscovio (Mc), livermorio (Lv), teneso (Ts).
¿Cuáles son los no metales?

Los no metales son elementos con propiedades muy distintas a las de los metales, aunque también existen compuestos llamados metaloides, que tienen propiedades y características intermedias entre los metales y no metales. Los no metales forman enlaces covalentes cuando forman moléculas entre ellos. Estos compuestos, a diferencia de los metales, no son buenos conductores de la corriente eléctrica y el calor, así como tampoco son brillantes.
El oxígeno, el carbono, el hidrógeno, el nitrógeno, el fósforo y el azufre, que son los elementos fundamentales para la vida, son parte de los no metales. Estos elementos no metálicos pueden ser sólidos, líquidos o gaseosos.
Están clasificados principalmente como:
- Halógenos. Flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y teneso (Ts).
- Gases nobles. Helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn), oganesón (Og).
- Otros no metales. Hidrógeno (H), carbono (C), azufre (S), selenio (Se), nitrógeno (N), oxígeno (O) y fósforo (P).
Más en: No metales
Referencias
- “Metal” en Wikipedia, La Enciclopedia Libre.
- “Los metales” en Área tecnología.
- 20 ejemplos de metales y no metales.
