Conductividad eléctrica
Te explicamos qué es la conductividad eléctrica y en base a qué varía. Conducción eléctrica de los metales, del agua y del suelo.

¿Qué es la conductividad eléctrica?
La conductividad eléctrica es la capacidad de la materia para permitir el flujo de la corriente eléctrica a través de sus partículas. Dicha capacidad depende directamente de la estructura atómica y molecular del material, así como de otros factores físicos como la temperatura a la que se encuentre o el estado en el que esté (líquido, sólido, gaseoso).
La conductividad eléctrica es lo contrario a la resistividad, es decir, la resistencia al paso de la electricidad de los materiales. Hay entonces materiales buenos y materiales malos conductores eléctricos, en la medida en que sean más o menos resistentes.
El símbolo para representar la conductividad es la letra griega sigma (σ) y su unidad de medición es el siemens por metro (S/m) o 𝛀-1⋅ m-1. Para su cálculo se suelen tomar en cuenta también las nociones de campo eléctrico (E) y densidad de corriente de conducción (J), de la siguiente manera:
J = σE, de donde: σ = J/E
La conductividad varía dependiendo del estado en que se encuentre la materia. En los medios líquidos, por ejemplo, dependerá de la presencia de sales disueltas en ellos que generan iones cargados positiva o negativamente, y son los electrolitos responsables de conducir la corriente eléctrica cuando se somete el líquido a un campo eléctrico.
En cambio, los sólidos presentan una estructura atómica mucho más cerrada y con menor movimiento, así que la conductividad dependerá de la nube de electrones compartidos por las bandas de valencia y la banda de conducción, que varía según la naturaleza atómica de la materia: los metales son buenos conductores eléctricos y los no metales, en cambio, buenos resistentes (o aislantes, como el plástico).
Ver además: Conductividad térmica
Conductividad del agua
El agua en líneas generales es un buen conductor eléctrico. Sin embargo, dicha capacidad depende de su margen de Sólidos Disueltos Totales (TDS), ya que la presencia de sales y minerales en el agua forma los iones electrolíticos que permiten el paso de la corriente eléctrica. Prueba de ello es que el agua destilada, a la que se le eliminan (utilizando destilación y otros métodos) todos los iones disueltos en ella, y no conduce la electricidad.
De esta manera, la conductividad del agua salada es mayor a la del agua dulce. Se puede registrar el incremento en la tasa de conductividad a medida que se añaden iones disueltos en el líquido, hasta alcanzar un tope de concentración iónica en el cual se forman pares de iones, positivos con negativos, que anulan su carga y impiden que la conductividad se incremente más.
Conductividad del suelo

Los suelos, en general, presentan distinta conductividad eléctrica, dependiendo de diversos factores como la irrigación hídrica o la cantidad de sales que presenten. Así como en el caso del agua, los suelos más salinos serán mejores conductores eléctricos que los menos salinos, y esta distinción está determinada muchas veces por la cantidad de agua que reciben (ya que el agua puede “lavar” las sales del suelo).
Este nivel de salinidad se confunde a menudo con la sodicidad del suelo (la presencia de sodio), cuando en realidad la salinidad se refiere a la abundancia de los cationes de sodio (Na+), potasio (K+), calcio (Ca2+) y magnesio (Mg2+), junto a los cationes de cloro (Cl–), sulfato (SO42-), bicarbonato (HCO3–) y carbonato (CO32-).
Así, en muchos casos se emplean técnicas como el lavado (para los suelos muy salinos) o la inyección de otros elementos neutralizadores (como el azufre) para los muy básicos. Esto puede a menudo determinarse mediante pruebas de conducción eléctrica.
Conductividad de los metales
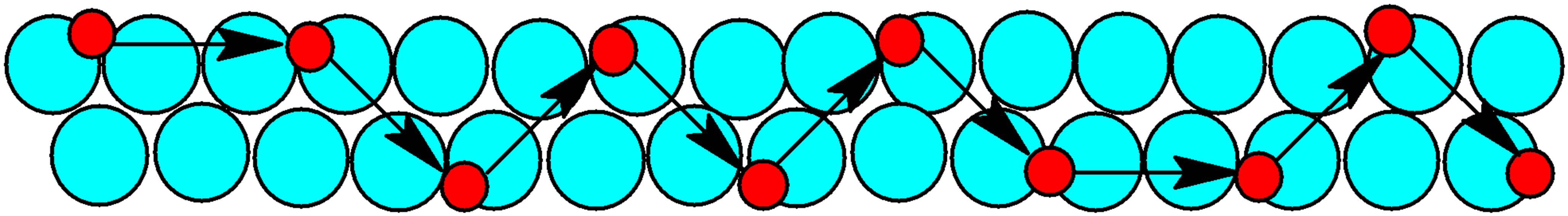
Los metales son, en líneas generales, excelentes conductores eléctricos. Esto se debe a que los átomos de este tipo de material se combinan por formación de enlaces metálicos. En los metales los electrones permanecen alrededor del metal como una nube, desplazándose alrededor de los núcleos atómicos estrechamente unidos, y son ellos los que permiten el flujo eléctrico.
Al aplicar el metal a un campo eléctrico, los electrones fluyen libremente de un extremo a otro del metal, tal y como ocurre también con el calor, del cual son a la vez buenos transmisores. Por eso se emplea el cobre y otros metales en el tendido eléctrico y en los dispositivos electrónicos. En la siguiente figura se representa esquemáticamente el flujo de electrones (en rojo) cuando se aplica un campo eléctrico a un metal: