Hidrólisis
Te explicamos qué es la hidrólisis y en qué consiste esta reacción química. Además, los tipos de hidrólisis que existen.

¿Qué es la hidrólisis?
La hidrólisis es una reacción química en la que moléculas de agua (H2O) se dividen en sus átomos componentes (hidrógeno y oxígeno). A su vez, en el proceso de hidrólisis, los átomos que componen las moléculas de agua pasan a formar enlaces químicos con la sustancia que reacciona con el agua. La hidrólisis es una reacción muy importante, pues el agua es el disolvente más usado mundialmente.
El nombre específico de esta reacción proviene de los vocablos griegos hydro (“agua”) y lýsis (“ruptura”), de donde se desprende que es una forma de ruptura de una molécula determinada de soluto, cuando la hace reaccionar con agua. En términos de química orgánica, se trata del proceso exactamente opuesto a la reacción de condensación, que es la combinación de dos moléculas orgánicas, en las que se obtiene un producto y una molécula de agua.
Existen diversas formas de hidrólisis, dependiendo de las sustancias que se hacen reaccionar con el agua:
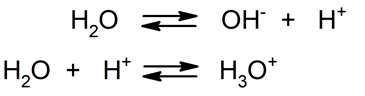
- Hidrólisis ácido-base. En esta reacción el agua se divide en un ion hidroxilo (OH–) y un protón (H+), que es inmediatamente hidratado para formar un ion hidronio (H3O+). Así, el agua pura manifiesta esta reacción espontáneamente.
![]()
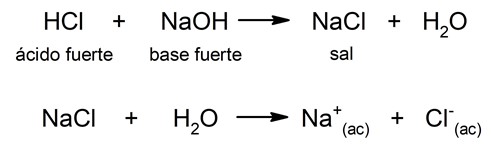
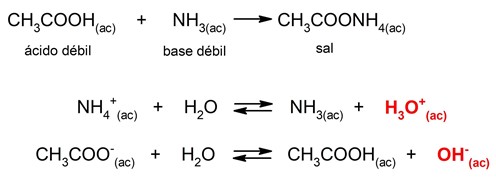
Cuando se añaden determinadas sustancias al agua se puede modificar el equilibrio de la reacción anterior. Por ejemplo, si añadimos sales, dependiendo de su solubilidad, sus aniones o cationes se pueden combinar con los iones OH– y H3O+, lo que puede provocar que varíe el pH de la disolución final. Así, existen cuatro clasificaciones para la hidrólisis ácido-base según el tipo de sal que se añada al agua:- Hidrólisis de sal de ácido fuerte-base fuerte. Cuando se diluye una sal proveniente de un ácido y una base fuerte en agua, no se produce casi hidrólisis, debido a lo que no se altera el equilibrio de disociación del agua. El pH en este caso será neutro. Por ejemplo:
![]()
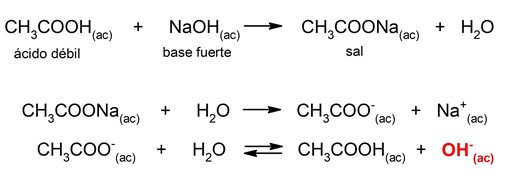
- Hidrólisis de sal de ácido débil-base fuerte. Se combinan el anión de la sal (proveniente del ácido débil y la base fuerte) y un protón del agua, liberando iones hidroxilo, debido a lo que el pH resultante será básico. Por ejemplo:
![]()
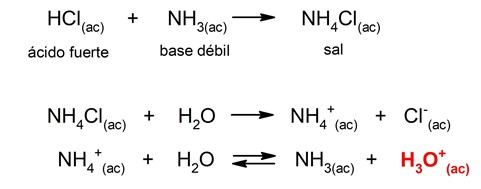
- Hidrólisis de sal de ácido fuerte-base débil. El catión de la sal (proveniente del ácido fuerte y la base débil) cede un protón al agua para formar un ion hidronio (H3O+), debido a lo que el pH resultante será ácido. Por ejemplo:
![]()
- Hidrólisis de sal de ácido débil-base débil. El catión de la sal (proveniente de la base débil) se combina con el agua liberando un ion hidronio (H3O+) y el anión de la sal (proveniente del ácido débil) se combina con el agua liberando un ion hidroxilo (OH–). El pH resultante dependerá de las cantidades de iones hidronio e hidroxilo producidos. Si se produce más ion H3O+ que ion OH– , el pH será ácido, y si se produce más ion OH– que ion H3O+, el pH será básico. Por otra parte, si las cantidades producidas de ambos iones son iguales, el pH resultante será neutro. Por ejemplo:
![]()
- Hidrólisis de sal de ácido fuerte-base fuerte. Cuando se diluye una sal proveniente de un ácido y una base fuerte en agua, no se produce casi hidrólisis, debido a lo que no se altera el equilibrio de disociación del agua. El pH en este caso será neutro. Por ejemplo:
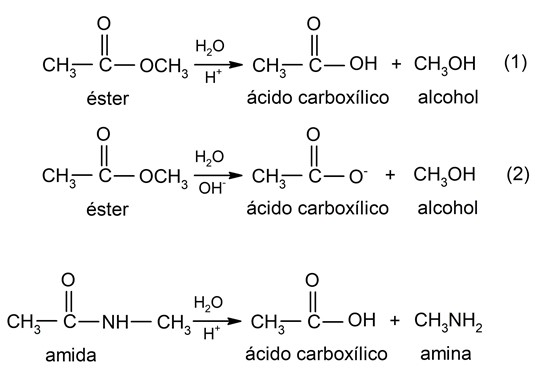
- Hidrólisis de amidas y ésteres. En estos tipos de sustancias orgánicas, la hidrólisis puede ocurrir en medio ácido o básico. En el caso de los ésteres, se hidrolizan en medio ácido (1) y básico (2), generando ácidos carboxílicos y alcoholes. El proceso de hidrólisis de ésteres también se denomina saponificación (hidrólisis de triglicéridos para obtener jabones). Por otra parte, las amidas generalmente se hidrolizan en medio ácido, descomponiéndose en aminas y ácidos carboxílicos. Por ejemplo:
![]()
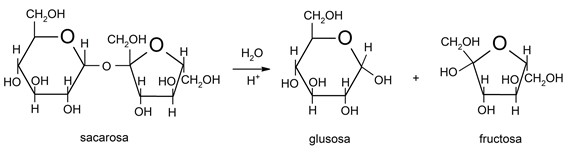
- Hidrólisis de polisacáridos. Los polisacáridos (azúcares) pueden hidrolizarse y descomponerse (rompiendo sus enlaces glucosídicos, que son enlaces entre monosacáridos para formar polisacáridos) en polisacáridos más simples, en disacáridos o en monosacáridos. En el proceso de hidrólisis un hidrógeno de la molécula de agua se enlaza al oxígeno del extremo de una molécula de azúcar, mientras que el hidroxilo se enlaza al extremo del resto. La hidrólisis de polisacáridos es un proceso llevado a cabo regularmente por las formas de vida.
![]()
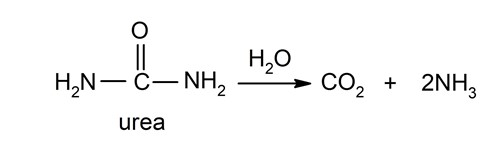
- Hidrólisis enzimática. Es la hidrólisis que se produce en presencia de enzimas (compuestos orgánicos que generalmente aumentan la velocidad de las reacciones químicas) llamadas hidrolasas. Por ejemplo, la urea amidohidrolasa es una enzima que interviene en la hidrólisis de la urea:
![]()
Ver además: Química inorgánica
Referencias
- Hidrólisis de los polisacáridos. Bioquímica y Biología molecular en línea. Dr Eggar Vázques Contreras
- “Hidrólisis” entrada de Wikipedia, la Enciclopedia Libre.