Solubilidad
Te explicamos qué es la solubilidad en química y qué factores la afectan. Además, qué es el producto de solubilidad y diversos ejemplos.

¿Qué es la solubilidad?
En química, la solubilidad es la capacidad de un cuerpo o de una sustancia determinada (llamada soluto) de disolverse en un medio determinado (llamado solvente); es decir, es la cantidad máxima de un soluto que un solvente puede recibir en determinadas condiciones ambientales.
El soluto es la sustancia que se disuelve en un determinado solvente. Puede ser un sólido, un líquido o un gas. Por lo general, el soluto se encuentra en menor cantidad que el solvente en una disolución.
El disolvente o solvente es la sustancia en la que se disuelve un determinado soluto. Por lo general, el solvente se encuentra en mayor cantidad que el soluto en una disolución.
La solubilidad se puede expresar mediante unidades de concentración, como la molaridad o la molalidad, por ejemplo.
La concentración molar (referida a la molaridad) se define como la cantidad de moles de soluto por litro de disolución (o unidad equivalente), y se calcula de la siguiente forma:
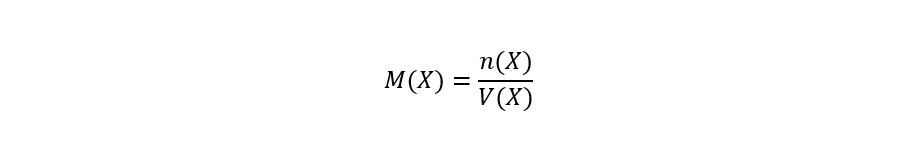
Donde:
- M(X). Molaridad de la sustancia X expresada en mol/L.
- n(X). Cantidad de sustancia de la sustancia X expresada en moles (mol).
- V(X). Volumen de disolución expresado en litros (L) o unidades equivalentes.
La concentración molal (referida a la molalidad) se define como el número de moles de soluto en un kilogramo de disolvente, y se calcula de la siguiente forma:
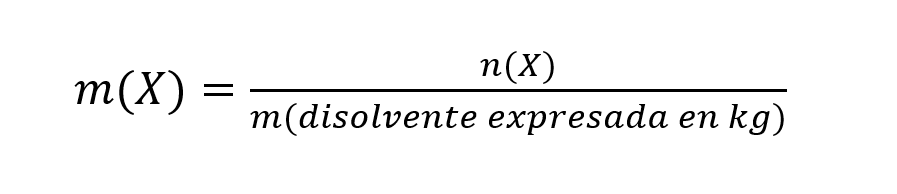
Donde:
- m(X). Es la molalidad de la sustancia X expresada en mol/(kg de solvente).
- n(X). Es la cantidad de sustancia de la sustancia X expresada en moles (mol).
- m(disolvente expresada en kg). Es la masa de disolvente expresada en kg.
Sin embargo, la solubilidad no es una característica universal de todas las sustancias. Algunas se disuelven con facilidad, otras más difícilmente y algunas, simplemente no se disuelven.
Todo depende también de cuáles sean las sustancias que estemos mezclando. El agua, referida comúnmente como el solvente universal, no puede disolver del todo al aceite, por ejemplo.
Pero incluso cuando un solvente logra disolver un soluto, lo hace hasta cierto punto, debido a lo que las disoluciones se pueden clasificar en:
- Saturadas. Cuando no se puede disolver más soluto, es decir, cuando la disolución tiene el máximo de soluto que admite el solvente.
- Insaturadas. Cuando se puede seguir disolviendo más soluto en la disolución.
- Sobresaturadas. Cuando la disolución tiene más soluto del que puede disolver. Una disolución sobresaturada se puede lograr modificando ciertas condiciones, como por ejemplo la temperatura, para lograr que se disuelva más soluto que el máximo que admite la disolución.
Ver también: Soluto y solvente
Factores que afectan la solubilidad

En principio, la solubilidad de una sustancia depende de con cuál otra la estemos mezclando. A grandes rasgos, las sustancias se clasifican en:
- Hidrosolubles. Son aquellas que pueden disolverse más fácilmente (o del todo) en agua.
- Liposolubles. Son aquellas que pueden disolverse más fácilmente en aceites.
Por otra parte, la solubilidad de las sustancias depende de los siguientes factores:
Temperatura. La mayoría de los sólidos aumenta su solubilidad en agua al aumentar la temperatura, aunque existen algunas excepciones. También los compuestos orgánicos, por lo general, aumentan su solubilidad al aumentar la temperatura. Este aumento de solubilidad al aumentar la temperatura se debe a que aumentan las interacciones entre las partículas del soluto y el solvente, por lo que se pueden romper las fuerzas intermoleculares entre ellos. Por otra parte, los solutos gaseosos tienen un comportamiento distinto, pues al aumentar la temperatura aumenta su solubilidad en solventes orgánicos, pero disminuye en agua debido a que el gas tiende a escapar del líquido con el aumento de la temperatura.
Por ejemplo, un vaso de agua disuelve una cantidad determinada de azúcar, hasta que el exceso empieza a precipitarse en el fondo. Si calentamos dicho vaso de agua, notaremos cómo el exceso empieza a desaparecer, aumentando la solubilidad del soluto en el solvente.
Presión. La presión influye en la solubilidad de los solutos gaseosos principalmente. Al aumentar la presión de un soluto gaseoso, aumenta su solubilidad en un cierto solvente.
Naturaleza del soluto y el solvente. Las sustancias con la misma polaridad son solubles entre sí, de lo que surge la frase: “semejante disuelve lo semejante”. Sin embargo, cuando un soluto y un solvente tienen polaridades distintas, son completamente insolubles entre sí, aunque siempre existe un rango de polaridades intermedias en el que pueden ser parcialmente solubles un soluto y un disolvente.
La polaridad es una propiedad de los compuestos químicos que tienen la tendencia a separar las cargas eléctricas en su estructura.
Las moléculas polares están constituidas por átomos cuya electronegatividad es muy diferente, mientras que las moléculas apolares están formadas por átomos con igual electronegatividad.
Pero la polaridad de una molécula también está determinada por la simetría de su estructura, por lo que pueden existir moléculas formadas por átomos cuya electronegatividad es diferente, pero están dispuestos de tal manera en la estructura molecular, que se anulan sus dipolos y finalmente la molécula es apolar.
Agitación. Agitar o revolver las disoluciones aumenta la solubilidad del soluto, pues contribuye a una mayor interacción entre el soluto y el solvente.
Ver además: Fuerzas de Van der Waals
Producto de solubilidad
Cuando hablamos de producto de solubilidad o producto iónico (abreviado Ksol o Ks), nos referimos al producto de las concentraciones molares de los iones que forman un compuesto, elevadas a sus respectivos índices estequiométricos de la ecuación de equilibrio. Así, mientras mayor sea la Ksol, más soluble será el compuesto. Esto se expresa con la siguiente fórmula, considerando la ecuación de equilibrio:
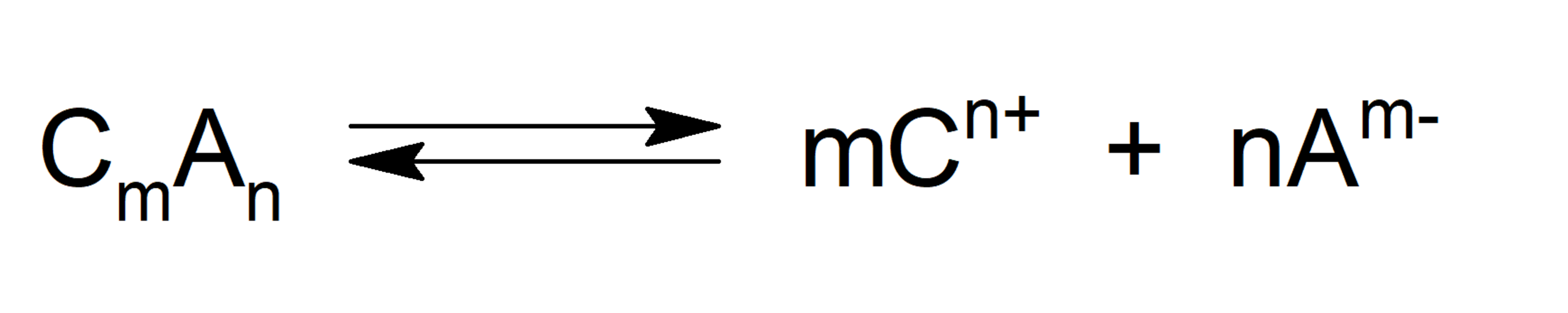
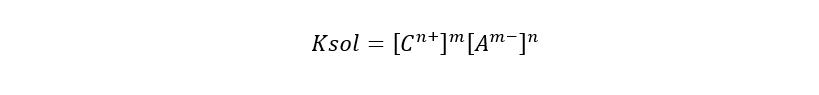
Donde:
- Ksol. Es el producto de solubilidad.
- [Cn+]m. Es la concentración molar del catión elevada al coeficiente estequiométrico m.
- [Am-]n. Es la concentración molar del anión elevada al coeficiente estequiométrico n.
Ejemplos de solubilidad

- Sal disuelta en agua. La sal común (cloruro de sodio, NaCl) se disuelve fácilmente en agua, conforme a una tasa de 360 gramos por cada litro, siempre y cuando el agua se encuentre a 20 ºC. Si incrementamos la temperatura del solvente, la cantidad de sal que podemos disolver aumentará.
- Bebidas gaseosas. Las gaseosas enlatadas o embotelladas que consumimos a diario tienen una cantidad de dióxido carbónico (CO2) gaseoso disuelto en su interior, y por eso tienen su característico burbujeo. Para conseguirlo, las industrias sobresaturan la mezcla a condiciones de presión muy alta. Por eso, cuando las destapamos la presión se equilibra y comienza una fuga de gases.
- Soluciones yodadas. A menudo usamos disoluciones de yodo para curar heridas superficiales, que no pueden fabricarse con agua, pues el yodo no es soluble en ella. Por eso emplean alcohol, cuya tasa de solubilidad mejora y permite producir la mezcla.
- Café con leche. Para preparar un café con leche, agregamos la leche a la infusión y observamos en su cambio de colores cómo se mezclan. Esto se hace siempre con el café caliente, ya que la tasa de solubilidad de ambas sustancias aumenta con la temperatura. Si esperamos a que las sustancias se enfríen, en cambio, notaremos la formación de nata en la superficie, puesto que la solución se ha saturado más rápidamente.
Sigue con: Solución química
Referencias
- “Solubilidad” en Wikipedia.
- “Solubilidad” (video) en Educatina.
- “Solubilidad” (video) en Profe en [email protected].
- “Solubilidad” en Portal Educativo.
- “Solubility – an Overview” en ScienceDirect.
- “Solubility” en The Encyclopaedia Britannica.
