pH
Te explicamos qué es el pH y qué instrumentos se usan para medirlo. La escala de pH y ejemplos de compuestos ácidos, neutros y bases.

¿Qué es el pH?
El pH es una medida que sirve para establecer el nivel de acidez o alcalinidad de una disolución. La “p” es por “potencial”, por eso el pH se llama: potencial de hidrógeno.
Se expresa como el logaritmo negativo de base 10 de la concentración de iones hidrógeno. La siguiente ecuación representa esta definición:
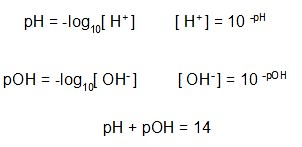
Ecuación 1: Ecuaciones para calcular pH y POH.
Por otra parte, el pOH es una medida de la concentración de iones hidroxilo en una disolución. Se expresa como el logaritmo negativo de base 10 de la concentración de iones hidroxilo y, a diferencia del pH, se utiliza para medir el nivel de alcalinidad de una disolución.
Un dato adicional es que en disolución acuosa a 25 ºC, la suma del pH y el pOH es igual a 14.
Ver además: Hidrólisis
¿Qué relación existe entre el nivel de acidez y el pH?
Las disoluciones ácidas tienen una alta cantidad de iones hidrógeno. Esto significa que tienen bajos valores de pH (ver ecuación 1) y, por tanto, su nivel de acidez es alto. Así, una disolución será más ácida o menos ácida dependiendo de la cantidad de iones hidrógeno que tenga.
Por otra parte, las disoluciones básicas (alcalinas) tienen bajas cantidades de iones hidrógeno. Esto significa que tienen elevados valores de pH (ver ecuación 1) y, por tanto, su nivel de acidez es bajo.
La escala de medida del pH
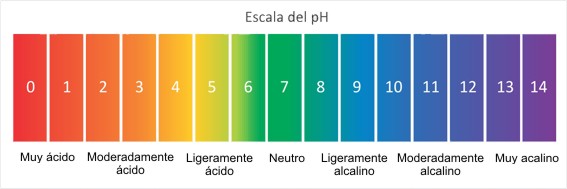
La escala de pH se utiliza para medir el grado de acidez de una disolución y, como el pH está relacionado con el pOH (ver ecuación 1), entonces sabiendo el grado de acidez de una disolución, también podemos saber su grado de basicidad.
Así, la escala de pH va desde el valor 0 hasta el 14. Por ejemplo, las sustancias con valor de pH=0 son las más ácidas (menos básicas), las que tienen pH=7 son neutras, y las que tienen pH=14, son las menos ácidas (más básicas).
Ejemplos de compuestos ácidos, básicos y neutros
Ejemplos de compuestos ácidos
- Ácidos de baterías. Tienen valores de pH entre 0 y 1. Su nivel de ácido es tan fuerte que es perjudicial para las especies.
- Lluvia ácida. Es un fenómeno que se produce por la acumulación de ácidos provenientes de fósiles y combustibles. Estas lluvias pueden tomar valores de pH entre 2 y 5 en la escala de pH. Cuando el pH se acerca a 2 puede producir la muerte de peces, plantas y otras especies. Cuando el pH se acerca a 5 produce menores daños, pero igual afecta la vida acuática y terrestre.
- Jugo de limón. Tiene valores de pH entre 2 y 3.
- Café. Tiene valor de pH=5, o valores muy cercanos.
Ejemplos de compuestos neutros
- Sangre
- Leche
Ejemplos de compuestos básicos
- Leche de magnesia. En la tabla de pH se ubica entre los valores 10 y 11. Este producto es de consumo
- Lejía o cloro. Tiene valores de pH alrededor de 13. Se usa para la limpieza del hogar, baños, cocina y tiene el poder de decolorar la ropa.
¿Cómo se mide el pH?

La forma de distinguir entre un compuesto ácido y uno básico es midiendo su valor de pH. En la actualidad existen numerosos métodos para medir el pH de una sustancia.
- Usando indicadores ácido-base. Los indicadores son compuestos que cambian de color al cambiar el pH de la disolución en que se encuentren. Por ejemplo, la fenolftaleína es un líquido que toma color rosa si es añadido a una base y se torna incoloro si es añadido a un ácido. Otro ejemplo es el papel tornasol: si se sumerge un fragmento en una disolución ácida se torna rojo-anaranjado, y si se sumerge en una solución básica se oscurece tomando color azul. También existen algunos tipos de papel tornasol con escalas de colores más específicas que indican valores de pH más exactos.
- Usando un potenciómetro o pH-metro. Es un equipo electrónico que nos da directamente el valor de pH de una solución. La medición del pH utilizando este equipo es más exacta que usando papel tornasol.
¿Qué son las soluciones Tampón o Buffers?
Las soluciones Tampón o Buffers son disoluciones que tienen la propiedad de mantener constante el pH de una disolución, aún cuando se le añaden ciertas cantidades de ácido o base.
Las disoluciones Buffer son de vital importancia en la regulación del pH de muchos procesos biológicos, debido a que para que ocurran muchos de ellos es necesario que el pH del medio en que ocurren se mantenga constante.
Referencias
- Elementos de química y física. Samuel Glasstone y David Lewis, 1969. Editorial: Médico Quirúrgica. 2da edición.
