Helio: historia, propiedades, estructura, riesgos, usos
El helio es un elemento químico cuyo símbolo es He. Se trata del primer gas noble de la tabla periódica, y suele ubicarse en el extremo derecho de la misma. Bajo condiciones normales es un gas inerte, pues ninguno de sus pocos compuestos es estable; se expande además con mucha rapidez y es la sustancia con el menor punto de ebullición de todas.
A nivel popular es un gas bastante conocido, ya que en innumerables eventos o fiestas infantiles es frecuente presenciar cómo un globo asciende hasta perderse en el cielo. No obstante, lo que se pierde realmente y para siempre hacia los rincones del sistema solar, y más allá, son los átomos de helio que se liberan una vez estalla o se desinfla el globo.

De hecho, hay quienes, y con mucha razón, considera que los globos de helio representan una práctica inapropiada para este gas. Por suerte, cuenta con usos más importantes e interesantes, gracias a sus propiedades físicas y químicas que lo separan de otros elementos químicos.
Por ejemplo, el helio líquido es tan frío que puede congelar cualquier cosa, como una aleación metálica, convirtiéndola en un material superconductor. Asimismo, es un líquido que manifiesta superfluidez, capaz de trepar por las paredes de un recipiente de vidrio.
Su nombre se debe a que fue identificado por vez primera en el Sol y no en la Tierra. Es el segundo elemento más abundante de todo el Universo y, aunque su concentración sea irrisoria en la corteza terrestre, puede obtenerse a partir de las reservas de gas natural y de minerales radiactivos de uranio y torio.
Aquí el helio demuestra otro hecho curioso: es un gas que abunda muchísimo más en el subsuelo que en la atmósfera, donde termina por escapar de la Tierra y de su campo gravitatorio.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Número atómico (Z)
- 2.3 Masa molar
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Punto triple
- 2.8 Punto crítico
- 2.9 Calor de fusión
- 2.10 Calor de vaporización
- 2.11 Capacidad calorífica molar
- 2.12 Presión de vapor
- 2.13 Energías de ionización
- 2.14 Solubilidad
- 2.15 Reactividad
- 2.16 Número de oxidación
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Isótopos
- 6 Riesgos
- 7 Usos
- 8 Referencias
El helio no fue descubierto en la Tierra sino en el Sol. De hecho, su nombre proviene de la palabra griega ‘helios’ que significa sol. La existencia del elemento por sí sola contrastaba la tabla periódica de Dmitri Mendeléyev, pues no había en ella sitio para un nuevo gas; es decir, para entonces no se sospechaba absolutamente nada respecto de los gases nobles.
El nombre ‘helio’, escrito como ‘helium’ en inglés, terminaba con el sufijo –ium refiriéndose a él como un metal; precisamente porque no podía admitirse la existencia de otro gas a parte del oxígeno, hidrógeno, flúor, cloro y nitrógeno.
Este nombre fue designado por el astrónomo inglés Norman Lockyer, quien estudió desde Inglaterra lo observado por el astrónomo francés Jules Janssen en la India, durante un eclipse solar en 1868.
Se trataba de una línea espectral amarilla de un elemento desconocido hasta entonces. Lockyer afirmó que esta se debía a la presencia de un nuevo elemento químico hallado en el Sol.
En 1895, casi veinte años más tarde, el químico escocés Sir William Ramsay reconoció el mismo espectro proveniente de un gas remanente al estudiar un mineral radiactivo: la cleveíta. Había pues, helio aquí también en la Tierra.

El helio es un gas incoloro, inodoro, que no tiene sabor y que además es inerte. No obstante, cuando se le aplica una descarga eléctrica, y dependiendo de la diferencia de voltaje, este comienza a brillar como una neblina grisácea-morada (imagen superior), para resplandecer luego con un fulgor anaranjado. Por lo tanto, las luces de helio son anaranjadas.
2
4,002 g/mol
-272,2 ºC
-268,92 ºC
-0,1786 g/L, en condiciones normales, es decir, en fase gaseosa.
-0,145 g/mL, en el punto de fusión, el helio líquido.
-0,125 g/mL, justo cuando el helio empieza a hervir.
-0,187 g/mL, a 0 K y 25 atm, es decir, el helio sólido a esas condiciones específicas de presión y temperatura.
2,177 K y 5,043 kPa (0,04935 atm)
5,1953 K y 0,22746 MPa (2,2448 atm)
0,0138 kJ/mol
0,0829 kJ/mol
20,78 J/(mol·K)
0,9869 atm a 4,21 K. Este valor sirve para darse una idea de lo fugaz que puede ser el helio y la facilidad con que puede escaparse a temperatura ambiente (cercano a los 298 K).
-Primera: 2372,3 kJ/mol (He+ gaseoso)
-Segunda: 5250,5 kJ/mol (He2+ gaseoso)
Las energías de ionización para el helio son especialmente altas porque el átomo gaseoso debe perder un electrón, el cual experimenta una fuerte carga nuclear efectiva. También puede entenderse si se considera el pequeño tamaño del átomo y qué tan “cercanos” están los dos electrones respecto al núcleo (con sus dos protones y dos neutrones).
En el agua, se disuelven 0,97 mL por cada 100 mL de agua a 0 ºC, lo cual significa que es poco soluble.
El helio es el segundo elemento químico menos reactivo en la naturaleza. En condiciones normales es acertado afirmar que se trata de un gas inerte; jamás (por lo que parece) podrá manipularse un compuesto de helio en una habitación o laboratorio sin que haya enormes presiones actuando sobre el mismo; o tal vez, temperaturas dramáticamente altas o bajas.
Un ejemplo lo vemos en el compuesto Na2He, el cual es estable solamente bajo una presión de 300 GPa, reproducida en una celda de yunque de diamante.
Si bien los enlaces químicos en el Na2He son “extraños” por tener sus electrones bien localizados en los cristales, distan de ser simples interacciones de Van der Walls y, por lo tanto, no consiste simplemente de átomos de helio atrapados por agregados moleculares. Es aquí donde surge la disyuntiva entre cuáles compuestos de helio son reales y cuáles no.
Por ejemplo, las moléculas de nitrógeno a altas presiones pueden aprisionar un átomo de helio para originar una especie de clatrato, He(N2)11.
Asimismo, están los complejos endoédricos de cationes de fullerenos, C60+n y C70+n, en cuyas cavidades pueden alojar átomos de helio; y el catión molecular HeH+ (He-H+), encontrado en nebulosas muy lejanas.
Quien por curiosidad intente calcular el número de oxidación para el helio en cualquiera de sus compuestos se encontrará que este es igual a 0. En el Na2He, por ejemplo, podría pensarse que su fórmula corresponde a hipotéticos iones Na2+He2-; pero tal sería asumir que posee un carácter iónico puro, cuando en realidad sus enlaces distan mucho de serlo.
Además, el helio no gana electrones porque no puede acomodarlos en el orbital 2s, indisponible energéticamente; y tampoco es posible que los pierda, debido al reducido tamaño de su átomo y la gran carga nuclear efectiva de su núcleo. Es por eso que el helio participa siempre (en teoría) como un átomo He0 en sus compuestos derivados.
El helio, como todos los gases observados en una macroescala, ocupa el volumen de los recipientes que lo almacena, teniendo por tanto forma indefinida. No obstante, cuando la temperatura desciende y comienza a enfriarse por debajo de los -269 ºC, el gas condensa en un líquido incoloro; el helio I, la primera de las dos fases líquidas para este elemento.
La razón de por qué el helio condensa a una temperatura tan baja se debe a las escasas fuerzas de dispersión que mantienen unidos sus átomos; cualquiera sea la fase considerada. Esto puede explicarse a partir de su configuración electrónica:
1s2
En la cual dos electrones ocupan el orbital atómico 1s. El átomo de helio puede visualizarse como una esfera casi perfecta, cuya homogénea periferia electrónica es poco propensa a polarizarse por la carga nuclear efectiva de los dos protones en el núcleo.
Así pues, los momentos dipolares espontáneos e inducidos son infrecuentes y muy débiles; por lo que la temperatura debe aproximarse al cero absoluto para que los átomos He se acerquen con la lentitud suficiente y logren que sus fuerzas dispersivas definan un líquido; o aún mejor, un cristal de helio.
En la fase gaseosa el espacio que separa los átomos He es tal que puede asumirse que se encuentran siempre separados los unos de los otros. Tal es así que en una ampolla, de poco volumen, el helio luce incoloro hasta que se le somete a una descarga eléctrica, la cual ioniza sus átomos en una neblina grisácea y poco brillante.
No obstante, en la fase líquida los átomos He, aun con sus débiles interacciones, ya no pueden “ignorarse” por más tiempo. Ahora la fuerza de dispersión les permite unirse momentáneamente para formar dímeros: He-He o He2. Por lo tanto, se puede pensar en el helio I como cúmulos vastos de He2 en equilibrio con sus átomos en fase de vapor.
Es por eso que el helio I es tan difícil de diferenciar de sus vapores. Si se derrama este líquido fuera de su hermético contenedor, escapa como una llamarada blanquecina.
Cuando la temperatura desciende todavía más, tocando los 2,178 K (-270,972 ºC), ocurre una transición de fase: el helio I se transforma en el helio II.
Desde este punto, el de por sí fascinante líquido de helio se convierte en un superfluido o fluido cuántico; es decir, sus propiedades macroscópicas se manifiestan como si los dímeros He2 fueran átomos individuales (y quizás así lo sean). Carece de completa viscosidad, pues no hay superficie que pueda frenar un átomo durante su deslizamiento o “trepada”.
Es por eso que el helio II puede subirse por las paredes de un recipiente de vidrio venciendo la fuerza de la gravedad; sin importar qué tan altas sean, siempre y cuando la superficie permanezca a la misma temperatura y, por ende, no se volatilice.
Debido a esto, el helio líquido no puede almacenarse en contenedores de vidrio, ya que escaparía ante la menor fisura o resquicio; muy parecido a como sucedería con un gas. En su lugar, se utiliza acero inoxidable para diseñar dichos recipientes (tanques Dewars).
Aunque la temperatura descendiera hasta los 0 K (el cero absoluto), la fuerza de dispersión entre los átomos He no sería lo suficientemente fuerte para ordenarlos en una estructura cristalina. Para que ocurra la solidificación, la presión debe aumentar hasta aproximadamente unas 25 atm; y entonces, aparecen cristales hexagonales compactos de helio (hcp).
Estudios geofísicos demuestran que esta estructura hcp permanece inalterada por mucho que se incremente la presión (hasta el orden de los giga pascales, GPa). No obstante, existe una región estrecha en su diagrama de presión-temperatura donde dichos cristales hcp sufren una transición a una fase cúbica centrada en el cuerpo (bcc).

El helio es el segundo elemento más abundante en todo el Universo, superado únicamente por el hidrógeno. Las estrellas producen constantemente inconmensurables cantidades de átomos de helio mediante la fusión de dos núcleos de hidrógeno durante el proceso de nucleosíntesis.
Asimismo, cualquier proceso radiactivo que emita partículas α es una fuente de producción de átomos de helio si estas interaccionan con los electrones del entorno; por ejemplo, con los de un cuerpo rocoso en depósitos de minerales radiactivos de uranio y torio. Estos dos elementos sufren decaimiento radiactivo, empezando por el uranio:
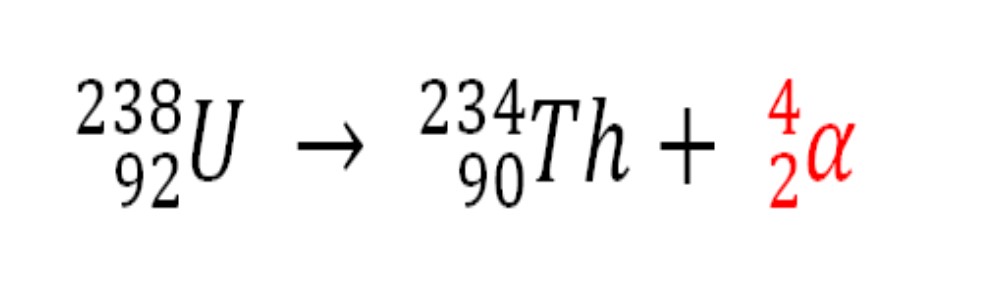
Por lo tanto, en las rocas donde estén concentrados estos minerales radiactivos quedarán atrapados los átomos de helio, los cuales se liberarán una vez sean digeridas en medios ácidos.
Entre algunos de estos minerales están la cleveíta, carnotita, y uraninita, todos compuestos por óxidos de uranio (UO2 o U3O8) e impurezas de torio, metales pesados y tierras raras. El helio, irrigado a través de canales subterráneos, puede terminar acumulándose en reservorios de gas natural, manantiales minerales o en hierros meteóricos.
Se estima que en la litósfera se produce anualmente una masa de helio equivalente a 3000 toneladas, a partir del decaimiento radiactivo del uranio y torio.
El helio es poco soluble en el agua, por lo que más temprano que tarde termina ascendiendo desde las profundidades (doquiera se halle su origen), hasta franquear las capas de la atmósfera y llegar por último al espacio sideral. Sus átomos son tan pequeños y ligeros que el campo gravitacional de la Tierra no puede retenerlos en la atmósfera.
Debido a lo anterior dicho, la concentración del helio tanto en el aire (5,2 ppm) como en los mares (4 ppt) es muy baja.
Si se quisiera entonces extraerlo de cualquiera de esos dos medios, la “mejor” opción sería el aire, al cual primero habría que someterlo a una licuefacción para condensar todos sus gases componentes, mientras el helio permanece en estado gaseoso.
No obstante, no es práctica la obtención del helio a partir del aire, sino de las rocas enriquecidas con los minerales radiactivos; o mejor aún, de las reservas de gas natural, donde el helio puede representar hasta el 7% de su masa total.
En lugar de someter a licuación el aire, es más fácil y rentable utilizar el gas natural, cuya composición en helio es indudablemente mucho más grande. Así pues, la materia prima por excelencia (comercial) para la obtención del helio es el gas natural, al cual también puede sometérsele a destilación fraccionada.
El producto final de la destilación se termina de purificar con carbón activado, por el que pasa a través un helio de gran pureza. Y finalmente, el helio se separa del neón mediante un proceso criogénico donde se emplea helio líquido.
El helio se presenta en la naturaleza predominantemente como el isótopo 4He, cuyo núcleo desnudo es la famosa partícula α. Este átomo de 4He tiene dos neutrones y dos protones. En menor abundancia se halla el isótopo 3He, el cual tiene solo un neutrón. El primero es más pesado (tiene mayor masa atómica) que el segundo.
Así pues, la pareja de isótopos 3He y 4He son las que definen las propiedades mesurables y lo que entendemos del helio como elemento químico. Dado que el 3He es más liviano, es de suponerse que sus átomos cuentan con mayor energía cinética y que, por lo tanto, necesitan de una temperatura aún más baja para cohesionar en un superfluido.
El 3He se considera una especie muy rara aquí en la Tierra; sin embargo, en suelos lunares es más abundante (2000 veces más, aproximadamente). Es por eso que la Luna ha sido objeto de proyectos e historias como posible fuente de 3He, el cual pudiera destinarse como combustible nuclear para las naves espaciales del futuro.
Entre otros isótopos del helio pueden mencionarse, con sus respectivos tiempos de vida media: 5He (t1/2= 7,6·10−22 s), 6He (t1/2= 0,8 s) y 8He (t1/2= 0,119 s).
El helio es un gas inerte y, por lo tanto, no participa en ninguna de las reacciones que ocurren dentro de nuestros cuerpos.
Sus átomos prácticamente entran y salen exhalados sin que sus interacciones con las biomoléculas produzcan un efecto ulterior; excepto en el sonido emitido de las cuerdas vocales, los cuales se vuelven más agudos y tienen mayor frecuencia.
Las personas que inhalan helio de un globo (con moderación), hablan con una voz aguda, parecida a la de una ardilla (o pato).
El problema reside en que si dicha persona inhala una cantidad inapropiada de helio, corre el riesgo de asfixiarse, ya que sus átomos desplazan a las moléculas de oxígeno; y por lo tanto, no podrá respirar hasta que exhale todo ese helio, que a su vez debido a su presión puede desgarrar el tejido pulmonar o causar barotraumas.
Se han reportado casos de personas que han fallecido por inhalar helio a causa de lo recién explicado.
Por otro lado, aunque no represente un riesgo de incendio dado su falta de reactividad hacia el oxígeno (u otra sustancia), si está almacenado bajo altas presiones y se escapa, su fuga puede ser físicamente peligrosa.
Las propiedades físicas y químicas del helio no solo hacen de él un gas especial, sino además una sustancia muy útil para aplicaciones que ameriten temperaturas en extremo bajas. En este apartado se abordarán algunas de estas aplicaciones o usos.
En algunos sistemas es necesario aumentar la presión (presurizar), y para ello se debe inyectar o suministrar un gas que no interaccione con ninguno de sus componentes; por ejemplo, con reactivos o superficies sensibles a reacciones indeseables.
Es así que la presión puede incrementarse con volúmenes de helio, cuya inercia química lo vuelve ideal para este propósito. La atmósfera inerte que facilita supera en ciertos casos a la del nitrógeno.
Para el proceso inverso, es decir, la purga, el helio también se utiliza debido a su capacidad para arrastrar todo el oxígeno, vapores de agua o cualquier otro gas, cuya presencia desea eliminarse. De esta manera la presión del sistema se reduce una vez se haya vaciado el helio.
El helio puede filtrarse a través de la más mínima fisura, por lo que sirve además para detectar fugas en tuberías, contenedores de alto vacío o tanques criogénicos.
En ocasiones la detección puede hacerse visualmente o mediante el tacto; sin embargo, mayormente un detector es lo que “arroja” la señal de dónde y cuánto helio está escapando del sistema bajo inspección.
Los átomos de helio, tal como se mencionó para los sistemas de purga, puede arrastrar consigo, dependiendo de su presión, moléculas más pesadas. Por ejemplo, este principio se utiliza cotidianamente en análisis de cromatografía de gases, ya que puede arrastrar la muestra atomizada a lo largo de la columna, donde interacciona con la fase estacionaria.

Debido a su baja densidad en comparación al aire y, nuevamente, a su falta de reactividad con el oxígeno, se ha utilizado para inflar globos en fiestas infantiles (mezclado con oxígeno para que nadie se asfixie por respirarlo), y dirigibles (imagen superior), sin que pueda representar un riesgo de incendio.

Cuando los buzos descienden a mayores profundidades se les dificultad respirar producto de la gran presión ejercida por el agua. Es por eso que en sus tanques de oxígeno se agrega helio para disminuir la densidad del gas que respiran y exhalan los buzos, y así, este pueda exhalarse con menor trabajo.
En el proceso de soldadura, el arco eléctrico aporta el calor suficiente para que los dos metales se unan. Si se realiza bajo una atmósfera de helio, el metal incandescente no reaccionará con el oxígeno del aire para convertirse en su óxido respectivo; por lo tanto, el helio impide que esto ocurra.
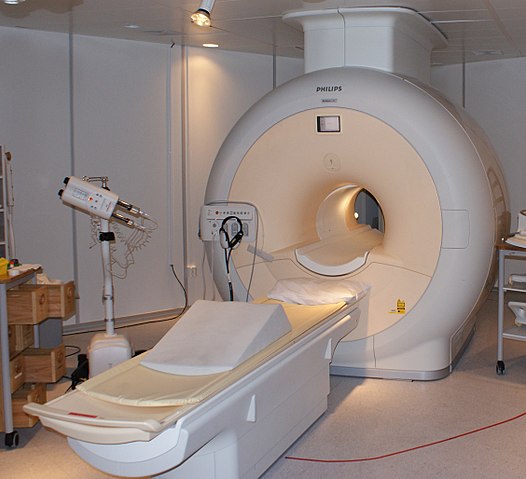
El helio líquido es tan frío que puede congelar los metales hasta transformarlos en superconductores. Gracias a esto, se ha podido fabricar imanes muy poderosos, los cuales, refrigerados con helio líquido, se han utilizado en escáneres de imágenes o espectrómetros de resonancia magnética nuclear.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Andy Extance. (17 de abril de 2019). Helium hydride ion detected in space for the first time: evidence found for elusive chemistry from the universe’s first minutes. Recuperado de: chemistryworld.com
- Peter Wothers. (19 de agosto de 2009). Helium. Chemistry in its Element. Recuperado de: chemistryworld.com
- Wikipedia. (2019). Helium. Recuperado de: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M., & Bassett, W. A. (1988). Crystal Structure and Density of Helium up to 232 Kbar. Recuperado de: articles.adsabs.harvard.edu
- National Center for Biotechnology Information. (2019). Helium. PubChem Database. CID=23987. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (06 de febrero de 2017). Up, up and away: Chemists say ‘yes,’ helium can form compounds. Utah State University. Recuperado de: phys.org
- Steve Gagnon. (s.f.). Isotopes of the Element Helium. Jefferson Lab. Recuperado de: education.jlab.org
- Advameg, Inc. (2019). Helium. Recuperado de: chemistryexplained.com
