Trióxido de azufre (SO3): estructura, propiedades, riesgos, usos
El trióxido de azufre es un compuesto inorgánico formado por la unión de un átomo de azufre (S) y 3 átomos de oxígeno (O). Su fórmula molecular es SO3. A temperatura ambiente, el SO3 es un líquido que desprende gases al aire.
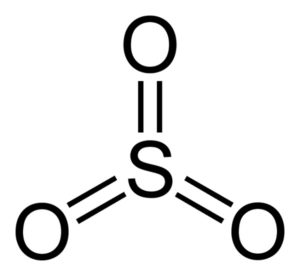
La estructura del SO3 gaseoso es plana y simétrica. Los tres oxígenos están situados de forma equitativa alrededor del azufre. El SO3 reacciona violentamente con el agua. La reacción es exotérmica, lo que significa que se produce calor, en otras palabras, se calienta mucho.
Cuando el SO3 líquido se enfría, se convierte en un sólido que puede tener tres tipos de estructura: alfa, beta y gamma. La más estable es la alfa, en forma de capas unidas entre sí constituyendo una red.
El trióxido de azufre gaseoso se emplea para preparar ácido sulfúrico fumante, también llamado óleum, por su parecido con aceite o sustancias oleosas. Otra de sus importantes aplicaciones es en la sulfonación de compuestos orgánicos, es decir, la adición de grupos –SO3– a estos. Así se pueden preparar sustancias químicas útiles como detergentes, colorantes, pesticidas, entre muchas otras.
El SO3 es muy peligroso, puede causar graves quemaduras, daños en los ojos y la piel. Tampoco debe ser inhalado ni ingerido pues puede causar la muerte por quemaduras internas, en la boca, esófago, estómago, etc.
Por estas razones, debe ser manipulado con mucha precaución. Nunca debe entrar en contacto con agua ni materiales combustibles como por ejemplo madera, papel, telas, etc., pues se pueden producir incendios. Tampoco se debe desechar ni debe llegar a alcantarillas por el peligro de explosión.
El SO3 gaseoso generado en procesos industriales no debe liberarse al ambiente, pues es uno de los responsables de la lluvia ácida que ya ha dañado grandes extensiones de bosques en el mundo.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades físicas
- 4 Propiedades químicas
- 5 Obtención
- 6 Usos
- 7 Riesgos
- 8 Impacto medioambiental
- 9 Referencias
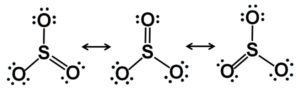
La molécula del trióxido de azufre SO3 en estado gaseoso posee una estructura plana triangular.
Esto quiere decir que tanto el azufre como los tres oxígenos se encuentran en un mismo plano. Además, la distribución de los oxígenos y de todos los electrones es simétrica.
En estado sólido se conocen tres tipos de estructura del SO3: alfa (α-SO3), beta (β-SO3) y gamma (γ-SO3).
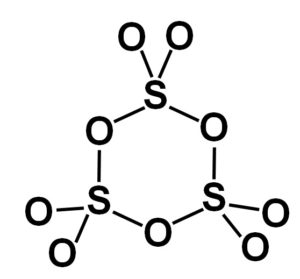
La forma gamma γ-SO3 contiene trímeros cíclicos, esto es, tres unidades de SO3 juntas formando una molécula cíclica o en forma de anillo.
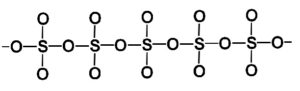
La fase beta β-SO3 posee cadenas infinitas helicoidales de tetraedros de composición SO4 unidos entre sí.
La forma más estable es el alfa α-SO3, similar a la beta pero con una estructura en capas, con las cadenas unidas formando una red.
-Trióxido de azufre
-Anhídrido sulfúrico
-Óxido sulfúrico
-SO3 gamma, γ-SO3
-SO3 beta, β-SO3
-SO3 alfa, α-SO3
A temperatura ambiente (alrededor de 25 ºC) y presión atmosférica, el SO3 es un líquido incoloro que emite humos al aire.
Cuando el SO3 líquido está puro a 25 ºC es una mezcla de SO3 monomérico (una sola molécula) y trimérico (3 moléculas unidas) de fórmula S3O9, también llamado SO3 gamma γ-SO3.
Al bajar la temperatura, si el SO3 es puro al llegar a 16,86 ºC, se solidifica o congela a γ-SO3, también llamado “hielo de SO3”.
Si contiene pequeñas cantidades de humedad (incluso trazas o cantidades extremadamente pequeñas) el SO3 polimeriza a la forma beta β-SO3 la cual forma cristales con un brillo sedoso.
Luego se forman más uniones generando la estructura alfa α-SO3, la cual es un sólido cristalino en forma de agujas que se asemeja al asbesto o amianto.
Cuando la alfa y la beta se funden generan la gamma.
80,07 g/mol
SO3 gamma = 16,86 ºC
Es la temperatura a la cual están presentes los tres estados físicos: sólido, líquido y gaseoso. En la forma alfa el punto triple es a 62,2 ºC y en la beta es a 32,5 ºC.
Al calentar la forma alfa esta tiene mayor tendencia a sublimar que a fundirse. Sublimar significa pasar del estado sólido al gaseoso directamente, sin pasar por el estado líquido.
Todas las formas del SO3 hierven a 44,8 ºC.
El SO3 líquido (gamma) posee una densidad de 1,9225 g/cm3 a 20 ºC.
El SO3 gaseoso tiene una densidad de 2,76 relativa al aire (aire = 1), lo que indica que es más pesado que el aire.
SO3 alfa = 73 mm Hg a 25 ºC
SO3 beta = 344 mm Hg a 25 ºC
SO3 gamma = 433 mm Hg a 25 ºC
Esto significa que la forma gamma tiende a evaporarse más fácilmente que la beta y esta que la alfa.
La forma alfa es la estructura más estable, las otras son metaestables, es decir, son menos estables.
El SO3 reacciona de forma enérgica con el agua para dar ácido sulfúrico H2SO4. Al reaccionar se produce mucho calor por lo que se desprende rápidamente vapor de agua de la mezcla.
Al estar expuesto al aire el SO3 absorbe humedad rápidamente, emitiendo vapores densos.
Es un agente deshidratante muy fuerte, esto significa que elimina agua fácilmente de otros materiales.
El azufre del SO3 posee afinidad por los electrones libres (o sea, electrones que no están en un enlace entre dos átomos) por lo que tiende a formar complejos con compuestos que los poseen como la piridina, la trimetilamina o el dioxano.
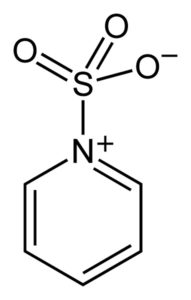
Al formar complejos, el azufre toma “prestados” los electrones del otro compuesto para satisfacer su carencia de estos. El trióxido de azufre sigue estando disponible en estos complejos, los cuales se utilizan en reacciones químicas para aportar SO3.
Es un poderoso reactivo sulfonante de compuestos orgánicos, lo que quiere decir que sirve para agregar con facilidad un grupo –SO3– a las moléculas.
Reacciona fácilmente con los óxidos de muchos metales para dar sulfatos de dichos metales.
Es corrosivo hacia los metales, tejidos animales y vegetales.
El SO3 es un material difícil de manejar por varias razones: (1) su punto de ebullición es relativamente bajo, (2) tiene tendencia a formar polímeros sólidos a temperaturas menores a 30 ºC y (3) presenta una alta reactividad hacia casi todas las sustancias orgánicas y el agua.
Puede polimerizar explosivamente si no contiene un estabilizador y hay presencia de humedad. Como estabilizadores se usan el dimetilsulfato o el óxido de boro.
Se obtiene por la reacción a 400 ºC entre el dióxido de azufre SO2 y el oxígeno molecular O2. Sin embargo, la reacción es muy lenta y se requieren catalizadores para aumentar la velocidad de esta.
2 SO2 + O2 ⇔ 2 SO3
Entre los compuestos que aceleran esta reacción están el metal platino Pt, el pentóxido de vanadio V2O5, el óxido férrico Fe2O3 y el óxido nítrico NO.
Una de sus principales aplicaciones consiste en la preparación de óleum o ácido sulfúrico fumante, llamado así porque emite vapores visibles a simple vista. Para obtenerlo se absorbe el SO3 en ácido sulfúrico concentrado H2SO4.

Esto se hace en unas torres especiales de acero inoxidable donde el ácido sulfúrico concentrado (el cual es líquido) va bajando y el SO3 gaseoso va subiendo.
El líquido y el gas entran en contacto y se van uniendo, formando el óleum que es un líquido de apariencia aceitosa. Este posee una mezcla de H2SO4 y SO3, pero también tiene moléculas de ácido disulfúrico H2S2O7 y trisulfúrico H2S3O10.
La sulfonación es un proceso clave en aplicaciones industriales a gran escala para la fabricación de detergentes, surfactantes, colorantes, pesticidas y productos farmacéuticos.
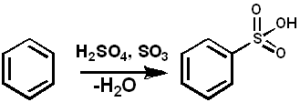
El SO3 sirve como agente sulfonante para preparar aceites sulfonados y detergentes alquil-aril-sulfonados, entre muchos otros compuestos. A continuación se muestra la reacción de sulfonación de un compuesto aromático:
ArH + SO3 → ArSO3H
Para las reacciones de sulfonación se puede utilizar óleum o SO3 en forma de sus complejos con piridina o con trimetilamina, entre otros.
El gas SO3 se ha usado en el tratamiento de minerales. Los óxidos simples de los metales pueden convertirse en los sulfatos mucho más solubles al tratarlos con SO3 a temperaturas relativamente bajas.
Los minerales de sulfuros como la pirita (sulfuro de hierro), calcosina (sulfuro de cobre) y millerita (sulfuro de níquel) son las fuentes de metales no-ferrosos más económicas, por lo que el tratamiento con SO3 permite obtener fácilmente estos metales y a bajo costo.
Los sulfuros de hierro, níquel y cobre reaccionan con el gas SO3 aún a temperatura ambiente, formando los respectivos sulfatos, los cuales son muy solubles y pueden ser sometidos a otros procesos para obtener el metal puro.
El SO3 sirve para preparar ácido clorosulfúrico también llamado ácido clorosulfónico HSO3Cl.
El trióxido de azufre es un oxidante muy poderoso y se usa en la manufactura de explosivos.
El SO3 es un compuesto altamente tóxico por todas las rutas, esto es, inhalación, ingestión y contacto con la piel.
Irrita y corroe las membranas mucosas. Causa quemaduras en la piel y en los ojos. Sus vapores son muy tóxicos al ser inhalados. Se producen quemaduras internas, dificultad para respirar, dolor en el pecho y edema pulmonar.

Es venenoso. Su ingestión genera severas quemaduras de boca, esófago y estómago. Además, se sospecha que es carcinógeno.
Representa peligro de incendio al entrar en contacto con materiales de origen orgánico como madera, fibras, papel, aceite, algodón, entre otros, especialmente si están húmedos.
También existe riesgo si entra en contacto con bases o agentes reductores. Se combina con agua de forma explosiva, formando ácido sulfúrico.
El contacto con los metales puede producir gas hidrógeno H2 el cual es muy inflamable.
Debe evitarse calentarlo en vasijas de vidrio para prevenir posible ruptura violenta del recipiente.
El SO3 es considerado uno de los mayores contaminantes presentes en la atmósfera terrestre. Esto se debe a su rol en la formación de aerosoles y su contribución a la lluvia ácida (debido a la formación de ácido sulfúrico H2SO4).

El SO3 se forma en la atmósfera por la oxidación del dióxido de azufre SO2. Al formarse el SO3 este reacciona rápidamente con el agua para formar ácido sulfúrico H2SO4. Según estudios recientes, hay otros mecanismos de transformación del SO3 en la atmósfera, pero debido a la gran cantidad de agua presente en esta se sigue considerando mucho más probable que el SO3 se convierta principalmente en H2SO4.
El SO3 gas o los desechos gaseosos industriales que lo contengan no deben ser descargados a la atmósfera debido a que es un contaminante peligroso. Es un gas sumamente reactivo y, como ya se ha dicho anteriormente, en presencia de humedad del aire el SO3 se convierte en ácido sulfúrico H2SO4. Por lo tanto, en el aire el SO3 persiste en forma de ácido sulfúrico conformando pequeñas gotitas o aerosol.
Si las gotitas de ácido sulfúrico entran en el tracto respiratorio del ser humano o animales, crecen rápidamente de tamaño debido a la humedad presente allí, por lo que tienen la posibilidad de penetrar en los pulmones. Uno de los mecanismos por los que la niebla ácida de H2SO4 (es decir SO3) puede producir fuerte toxicidad es porque cambia el pH extracelular e intracelular de los organismos vivos (plantas, animales y ser humano).
Según algunos investigadores, la niebla de SO3 es la causante del aumento de los asmáticos en una zona de Japón. La niebla de SO3 tiene un efecto muy corrosivo hacia los metales, por lo que las estructuras metálicas construidas por el ser humano como por ejemplo algunos puentes y construcciones se pueden ver muy afectadas.
El SO3 líquido no debe ser desechado en el drenaje de aguas sucias o las cloacas. Si se vierte hacia las alcantarillas puede crear peligro de incendio o de explosión. Si es derramado por accidente, no debe dirigirse un chorro de agua hacia el producto. Nunca debe absorberse en aserrín u otro absorbente combustible, pues puede generar incendios.
Debe absorberse en arena seca, tierra seca u otro absorbente inerte totalmente seco. El SO3 no debe ser vertido al ambiente y nunca debe dejarse entrar en contacto con este. Debe mantenerse lejos de fuentes de agua pues con esta produce ácido sulfúrico que es dañino para los organismos acuáticos y terrestres.
- Sarkar, S. et al. (2019). Influence of Ammonia and Water on the Fate of Sulfur Trioxide in the Troposphere: Theoretical Investigation of Sulfamic Acid and Sulfuric Acid Formation Pathways. J Phys Chem A.2019; 123 (14):3131-3141. Recuperado de ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Sulfuric acid and sulfur trioxide. Kirk-Othmer Encyclopedia of Chemical Technology. Volume 23. Recuperado de onlinelibrary.wiley.com.
- U.S. National Library of Medicine. (2019). Sulfur trioxide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Environmental Management of Sulfur Trioxide Emission: Impact of SO3 on Human Health. Environmental Management (2001) 27: 837. Recuperado de link.springer.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Ismail, M.I. (1979). Extraction of Metals from Sulphides Using Sulphur Trioxide in Fluidised Bed. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Recuperado de onlinelibrary.wiley.com.
